
【题目】在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以_____(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应____。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是____。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。 |
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。 |
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。 |
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。 |
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。
【答案】酸 Fe2++2H2O![]() Fe(OH)2+2H+ 抑制 Al3++3HCO3-=Al(OH)3↓+3CO2↑ D Al2O3
Fe(OH)2+2H+ 抑制 Al3++3HCO3-=Al(OH)3↓+3CO2↑ D Al2O3
【解析】
(1)氯化亚铁是强酸铁弱碱盐,水解显酸性,因此增大氢离子浓度,能抑制其水解。
(2)硫酸铝水解显酸性,碳酸氢钠水解显碱性,所以二者混合时水解相互促进,生成氢氧化铝沉淀和CO2气体。
(3)A不正确,因为中和反应是放热反应。B不正确,硝酸铵溶于水是吸热过程。C不正确,因为是增大了NH4+的浓度,抑制了氨水的电离,所以pH减小。选项D正确,红色加深,说明升高温度,平衡向正反应方向移动,即水解是吸热反应。
(4)氯化铝溶液中存在水解平衡AlCl3+3H2O![]() Al(OH)3+3HCl,加热促进水解,同时生成物氯化氢易挥发,进一步促进水解,所以最终得到的是氢氧化铝沉淀,灼烧得到氧化铝。
Al(OH)3+3HCl,加热促进水解,同时生成物氯化氢易挥发,进一步促进水解,所以最终得到的是氢氧化铝沉淀,灼烧得到氧化铝。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
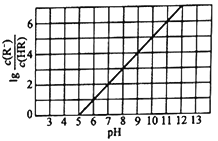
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH)c (HR)] 逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取纯净![]() 固体用如下方法制备
固体用如下方法制备![]() 。
。
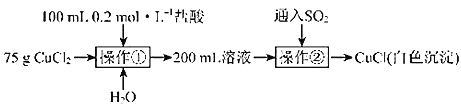
(4)操作②中反应的离子方程式为_________。
(5)操作①中若用![]() 盐酸代替
盐酸代替![]() 盐酸,再通入
盐酸,再通入![]() 后,无白色沉淀产生。对此现象有如下两种猜想:
后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:![]() 过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、
过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、![]() 盐酸及________
盐酸及________![]() 配制
配制![]() 溶液,再进行操作②,观察是否有白色沉淀产生。
溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:____________。为验证此猜想,取少量白色沉淀加入饱和氯化钠溶液中,搅拌,观察白色沉淀是否溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:
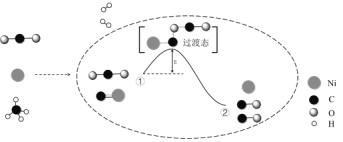
下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬独液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,等物质的量的C2H4和CH4所含的氢原子数均为4NA
B.1L0.4mol/L亚硫酸钠溶液中H2SO3、HSO3-、SO32-的总数为0.4NA
C.向含4molFeI2的溶液中通入等物质的量的Cl2,转移的电子数为4NA
D.100g98%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com