
(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| | | | |||||||||||||||
| | | | | h | | | | | |||||||||
| a | c | f | | i | | | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
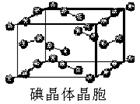
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
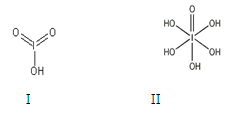
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学选修——3:物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
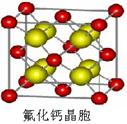
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
(5)D的氢化物的晶体结构如图所示,其化学式是 。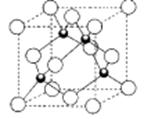
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: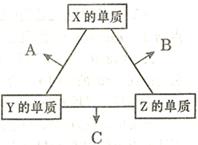
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)D元素在元素周期表中的位置 ,该元素常见氧化物有 和 (写出化学式)
(2)写出B、C单质生成E的化学方程式: 。
(3)12克A单质充分燃烧后的产物通人1L 1mol/LNaOH溶液中,所得溶液的溶质为 ,其物质的量为 mol。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com