
【题目】由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下所示:
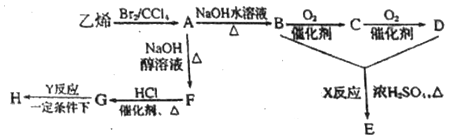
请回答下列问题:
(1)写出以下物质的结构简式:A____________,H_____________,C的化学名称_____________。
(2)写出以下反应的反应类型:X_____________,Y_______________。
(3)写出以下反应的化学方程式:
A→B:___________________________________________;
G→H:_________________________________。
B+D→E:________________________________________。
【答案】 ![]()
![]() 乙二醛 取代反应 加聚反应
乙二醛 取代反应 加聚反应 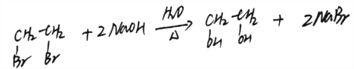
![]()

【解析】乙烯和溴发生加成反应生成A,A的结构简式为:![]() ,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
,A和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:![]() ,B被氧气氧化生成C,C的结构简式为:OHC-CHO,C被氧气氧化生成D,D的结构简式为:HOOC-COOH,B和D发生酯化反应生成E,E是环状酯,则E乙二酸乙二酯; A和氢氧化钠的醇溶液发生消去反应生成F,F的结构简式为:
,B被氧气氧化生成C,C的结构简式为:OHC-CHO,C被氧气氧化生成D,D的结构简式为:HOOC-COOH,B和D发生酯化反应生成E,E是环状酯,则E乙二酸乙二酯; A和氢氧化钠的醇溶液发生消去反应生成F,F的结构简式为:![]() ,F和氯化氢发生加成反应生成G氯乙烯,氯乙烯发生加聚反应生成H,H为聚氯乙烯。
,F和氯化氢发生加成反应生成G氯乙烯,氯乙烯发生加聚反应生成H,H为聚氯乙烯。
(1) 通过以上分析知,结构简式A为![]() ,H为
,H为![]() ;C的化学名称为乙二醛;正确答案:
;C的化学名称为乙二醛;正确答案: ![]() ;
; ![]() ; 乙二醛 。
; 乙二醛 。
(2)乙二醇和乙二酸在浓硫酸作用下加热反应生成生成乙二酸乙二酯,,该反应为取代反应;氯乙烯在一定条件下发生加聚反应生成高分子,该反应为加聚反应;正确答案:取代反应;加聚反应。
(3)A→B:1,2-二溴乙烷在氢氧化钠溶液加热的条件下发生取代反应生成乙二醇和溴化钠,反应方程式: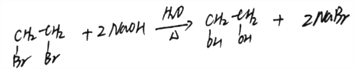 ;正确答案:
;正确答案: 。
。
G→H:一定条件下,氯乙烯发生加聚反应生成聚氯乙烯,反应方程式为![]() ;正确答案:
;正确答案:![]() 。
。
B+D→E:乙二酸和乙二醇在浓硫酸加热条件下发生酯化反应生成乙二酸乙二酯,反应的方程式: ;正确答案:
;正确答案: 。
。


科目:高中化学 来源: 题型:
【题目】下列俗名和化学式配对错误的是 ( )
A. 重晶石BaSO4 B. 熟石膏CaSO42H2O
C. 胆矾CuSO4 5H2O D. 漂粉精的有效成份Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种盐A和KOH反应,生成有刺激性气味的气体B,B经过一系列氧化再溶于水可得到酸C,B和C反应又可以生成A,则A是 ( )
A. NH4Cl B. (NH4)2SO4 C. NH4NO3 D. (NH4)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中互为同分异构体的有_______,互为同系物的是________。
A.CH3CH2CH2CHO与![]() B.
B.![]() 与
与![]()
C.![]() 与
与![]() D.
D.![]() 与
与![]()
E.![]() 与
与![]() F.戊烯和环戊烷
F.戊烯和环戊烷
(2)0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。试回答:
①烃A的分子式为__________________;
②烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,其中A是单质,它们之间存在如图转化关系
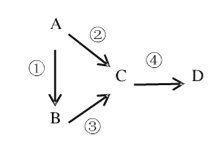
Ⅰ.若D是红棕色气体;B气体溶于水后,溶液为碱性。
(1)请写出A的化学式__________,反应③的化学反应方程式为_____________。
(2)D溶于水形成的稀溶液与铜反应的离子方程式为__________,该反应的实验现象为____________(写出两条)。
Ⅱ若B、D既能与强酸溶液反应,又能与强碱溶液反应,反应②③均为强酸条件。
(1)反应④可以通过滴加氨水实现,该反应的离子方程式为____________。
(2)请写出A用于焊接铁轨的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
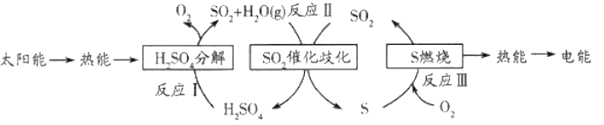
【题目】研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
请回答下列问题:
(1)工业生产H2SO4时最后一步反应的化学方程式是_______________________。
(2)反应Ⅰ的化学方程式是_________________。其中氧化产物与还原产物的物质的量之比是________________________。
(3)反应Ⅱ为歧化反应,其中硫元素的化合价是由____________到________________。
(4)反应Ⅲ中硫在氧气中燃烧现象是________________________________。检验生成的二氧化硫的方法是_________________________________________________。观察到的现象是_______________________________。
(5)上述过程中有__________种形式的能量转化,此过程中可能造成一种环境问题是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。
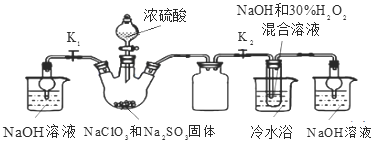
A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法错误的是
A. 胶体粒子很小,能透过半透膜
B. 胶体与溶液的本质区别是分散质粒子直径大小的不同
C. 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘胶体中的胶粒带电。
D. 胶体能产生丁达尔现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com