
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被![]() 腐蚀,其电化学腐蚀原理如图所示,下列说法正确的是
腐蚀,其电化学腐蚀原理如图所示,下列说法正确的是
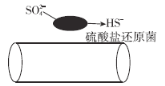
A.温度升高会使铁管道腐蚀程度加重
B.正极电极反应为![]()
![]()
C.酸性条件下,还原菌失去活性,铁管道不易被腐蚀
D.镀锌可保护铁管道不易被腐蚀
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,在2 L的密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
2NH3(g) 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法错误的是:
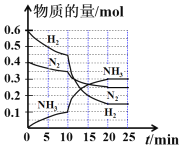
A. 0~10 min内,以NH3表示的平均反应速率为0.005 mol L-1 min-1
B. 10~20 min内,NH3浓度变化的原因可能是加入催化剂或缩小容器体积
C. 该反应在20 min时达到化学平衡状态
D. N2的平衡转化率与H2平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
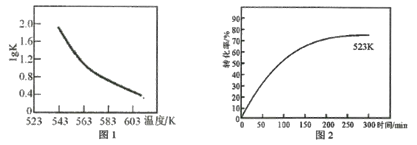
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
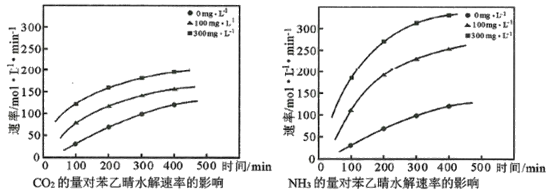
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
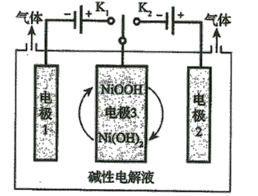
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol![]() 溶于水,转移的电子数目为0.1
溶于水,转移的电子数目为0.1![]()
B.标准状况下,2.24 L氧气与2.3 g金属钠充分反应,转移的电子数为0.4![]()
C.64 g 铜粉与足量硫粉混合加热充分反应,转移电子数为![]()
D.18 g![]() 含有10
含有10![]() 个中子
个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
A. 实验室用装置A制取并收集二氧化硫
实验室用装置A制取并收集二氧化硫
B.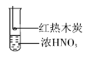 装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
装置B的气体产物中检测出CO2,由此不能说明木炭一定与浓硝酸发生了反应
C.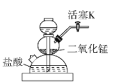 装置C可用于二氧化锰与浓盐酸反应制备氯气
装置C可用于二氧化锰与浓盐酸反应制备氯气
D.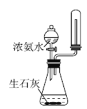 实验室用装置D制取少量氨气
实验室用装置D制取少量氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol浓硫酸溶于水时包含两个过程:一是部分硫酸分子分散在水里吸收热量,热效应为Δ![]() ;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ
;二是部分硫酸分子与水作用形成硫酸水化物释放热量,热效应为Δ![]() ,其中具体包含以下三个变化:①
,其中具体包含以下三个变化:①![]()
![]() ·
·![]() Δ
Δ![]() =Δ
=Δ![]()
②![]() ·
·![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
③![]()
![]() Δ
Δ![]() =Δ
=Δ![]()
下列说法正确的是
A.浓硫酸溶于水只有化学变化
B.Δ![]() Δ
Δ![]() <0
<0
C.Δ![]() <0
<0
D.Δ![]() =Δ
=Δ![]() +Δ
+Δ![]() +Δ
+Δ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com