
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。下列流程采用废旧锂离子电池正极材料(正极一般以铝箔作为基底,两侧均匀涂覆正极材料,正极材料包括一定配比的正极活性物质,如钴酸锂、磷酸铁锂、锰酸锂和三元材料等)制备镍钴锰酸锂三元正极材料(![]() )
)![]() )
)
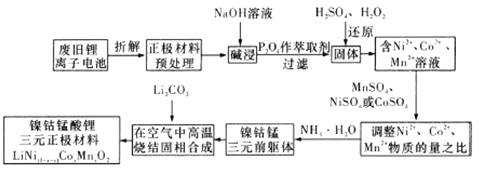
回答下列问题:
(1)写出正极碱浸过程中的离子方程式:________________;能够提高碱浸效率的方法有____________(至少写两种)。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_________________。
(3)![]() 中
中![]() 元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
元素化合价为_______________,其参与“还原”反应的离子方程式为___________。
(4)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是___________________。
(5)已知溶液中![]() 的浓度为
的浓度为![]() ,缓慢通入氨气,使其产生
,缓慢通入氨气,使其产生![]() 沉淀,列式计算
沉淀,列式计算![]() 沉淀完全时溶液的
沉淀完全时溶液的![]() ______________________(已知离子沉淀完全时
______________________(已知离子沉淀完全时![]() ,溶液体积变化忽略不计)
,溶液体积变化忽略不计)
(6)写出“高温烧结固相合成”过程的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
①25℃时,0.175 mol/L的H3BO3溶液pH约为_________。
②已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 4.7×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
①体系中H2的物质的量与反应时间的关系如表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
②图为产率与反应温度的关系曲线,NaBH4的产率在603K之前随温度升高而增大,在603K之后随温度升高而减小的原因是_________。

(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。

①通常状况下,实验测得3.8 g NaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
②![]() 为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg
为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg![]() 随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
随pH和温度的变化如图所示。溶液pH=4时,NaBH4_________(填“能”或“不能”)稳定存在,原因是_________(用离子方程式表示);T1_________T2。(填 “>”或“<”)
③硼氢化钠具有极强还原性,碱性条件可用于处理电镀废液中的CuSO4制得纳米铜,从而变废为宝。写出电镀阳极反应方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1 mol CH4与1molP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 含0.5 mol NH4NO3与 r mol NH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,Ⅹ、Y、Z均是由这些元素组成的二元化合物,它们存在转化关系:M![]() X+Y+Z,液态X常用作制冷剂,Y的组成元素位于同一主族,常温常压下Z为液体。下列说法不正确的是
X+Y+Z,液态X常用作制冷剂,Y的组成元素位于同一主族,常温常压下Z为液体。下列说法不正确的是
A. 原子半径:d>b>c>a
B. b、c、d对应简单氢化物的热稳定性和还原性强弱顺序一致
C. M既能与强酸溶液反应,又能与强碱溶液反应
D. b2c3、dc3均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
① H2(g) + ![]() O2(g) = H2O(
O2(g) = H2O(![]() );△H = -285kJ/mol
);△H = -285kJ/mol
② H2O(g) = H2(g) + ![]() O2(g); △H = + 241.8kJ/mol
O2(g); △H = + 241.8kJ/mol
③ C(s) + ![]() O2(g) = CO(g); △H = -110.4kJ/mol
O2(g) = CO(g); △H = -110.4kJ/mol
④ C(s) + O2(g) = CO2(g);△H = -393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是______________。(用序号填写)
(2)燃烧10g H2生成液态水,放出的热量为_____________。
(3)CO的燃烧热的热化学方程式为___________________________________。
(4)已知常温下拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是:( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. 碘和干冰的升华克服相同类型的作用力
C. NaOH是离子化合物,NH4NO3是共价化合物
D. NaHSO4溶于水时只破坏了离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com