
以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+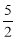 O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
科目:高中化学 来源:2016-2017学年辽宁省协作校高二上学期期中化学卷(解析版) 题型:选择题
下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL 0.lmol/L 氨水与 l0mL 0.lmol/L 盐酸混合 c(Cl-) > c(NH4+) > c(OH-) > c(H+)
B.10mL 0.lmol/L NH4Cl溶液与 5mL 0.2 mol/L NaOH溶液混合c(NH4+) >c(Cl-)>c(OH-) >c(H+)
C.l0mL 0.lmol/LCH3COOH溶液与5mL 0.2mol/L NaOH 溶液混合, c(Na+) = c(CH3COO-) > c(OH-) = c(H+)
D.10mL 0.5mol/L CH3COONa 溶液与5mL lmol/L 盐酸混合c(Cl-) = c(Na+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:选择题
某溶液中大量存在以下浓度的五种离子:0.4mol/L Cl﹣、0.8mol/L SO42﹣、0.2mol/L A l3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
l3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
A.Na+0.6mol/L B.CO32﹣ 0.2 mol/L
C.Mg2+0.4 mol/L D.Ba2+0.4mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mo | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.容器②中达平衡时放出的热量Q=23.15 kJ
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.平衡时,两个容器中NH3的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
将BaO2放入密闭的真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.气体密度增大 D.氧气压强不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:填空题
某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1?、OH? 、NO3? 六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子 、 、 。
(2)乙厂的废水中含有另外三种离子。对于该两厂的废水,可采取下列两种方法来处理。如果在乙厂废水中加一定量 ?选填:活性炭或铁粉),离子方程式是 ,并且能够回收其中的金属 (填写金属元素符号)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:选择题
在0.5 L某浓度的NaCl溶液中含有0.5mol Na+,该溶液的说法不正确的是
A.该溶液的物质的量浓度为1 mol·L-1
B.配制100 mL该溶液需用5.85 g NaCl
C.0.5 L该溶液含有58.5g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:实验题
某学生为测定未知浓度的硫酸溶液(已知滴定时供选择的指示剂有石蕊、酚酞),实验如下:用1.00m L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
L待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是 。
②该滴定操作中应选用的指示剂是 。
③在G操 作中如何确定终点? 。
作中如何确定终点? 。
(2)酸式滴定管用蒸馏水润洗后,未用待测液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是 。
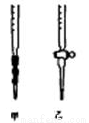
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算 结果到小数点后二位)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
在研究钠的性质时:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。本实验采用的研究方法是( )
①假说法 ②实验法 ③分类法 ④比较法
A.①②③④ B.①③ C.②④ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com