
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.AgNO3 B.NaCl C.CuCl2 D.H2SO4
科目:高中化学 来源: 题型:
【题目】已知酸性:H2SO3>H2CO3>HSO3->HCO3-。某无色溶液Y可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)。
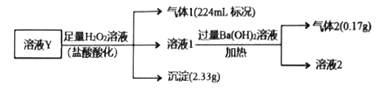
下列说法不正确的是
A. 溶液Y中一定不存在Fe3+、SO42-
B. 溶液Y中肯定存在HCO3-、HSO3-、Ba2+、NH4+
C. 溶液Y中一定含有Cl-,且n(Cl-)=0.01mol
D. 溶液Y中可能存在Na+,为确定其是否存在,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子最外层有2个电子,关于此元素的说法一定正确的是( )
A.ⅡA族元素
B.可能是金属元素,也可能是非金属元素
C.金属元素
D.ⅡA族或ⅡB族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 澄清石灰水跟过量CO2气体反应:Ca(OH)2+CO2=CaCO3↓+H2O
B. 稀硫酸与Cu反应:2H++Cu=Cu2++H2↑
C. 腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+
D. 铁粉加入AgNO3溶液中:Fe+Ag+=Fe2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在饱和Mg(OH)2溶液中,c(OH-)=1.0×10-4 mol·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将
A.变为原来的10-3倍 B.变为原来的10-2倍
C.变为原来的10倍 D.不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A. 碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,在循环过程中价态变化在-2价至+6价之间,以不同的状态(或形态)发生一系列的变化,请分析此图并回答有关问题,
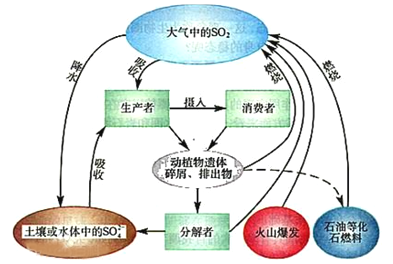
(1)硫循环与氮循环是自然界中两种重要的元素循环过程,下列关于这两种循环的说法正确的是_____
选项 | 比较 | 氮循环 | 硫循环 |
A | 异 | 氮元素会进入大气 | 硫元素不会进入大气 |
B | 碳循环过程有生物圈参与 | 硫循环过程无生物圈参与 | |
C | 同 | 人类活动对氮循环和硫循环都造成巨大影响 | |
D | 氮循环和硫循环对环境的影响是都能导致温室效应 | ||
(2)分解者可将含硫有机物分解为硫化氢,硫黄细菌和硫化细菌可将硫化氢进一步转变为元素硫或硫酸盐,下列关于硫化氢说法正确的是 _____________
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层都达到8电子结构
C.将硫化氢通入硫酸亚铁溶液,产生沉淀
D.硫化氢中硫元素为-2价,因此只有还原性,没有氧化性
E.硫化氢是一种无色臭鸡蛋气味的有毒气体
(3)硫化氢虽然有毒,但有研究发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用,请再举出一例类似硫化氢“亦正亦邪”物质的实证______________________。
(4)大气中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。收集某次酸雨样品,发现8小时内,样品pH一直在较小,其原因可能是_____________________。(用化学方程式表示)
(5)研究发现,空气其中少量的NO2也能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用不符的是___________(多选)
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4中
C.浓H2SO4滴入萤石中,加热
D.向盐酸中加入浓硫酸产生白雾
(6)为了防治酸雨,工业上常采用“钙基固硫法”即将生石灰和含硫的煤混合后燃烧,燃烧时硫、氧气和生石灰共同作用,使硫元素转移到炉渣中,大部分硫元素最终转化为固体盐是_______。

(7)若采用如图所示的流程处理则气体a是_______________,Y一定含有______________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:

反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
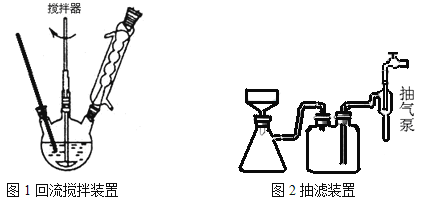
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
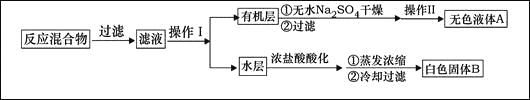
(1)无色液体A的结构简式为 。操作Ⅱspan>为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com