
 将锌片和铜片用导线相连后一同插入稀硫酸中,导线上便有电流通过.
将锌片和铜片用导线相连后一同插入稀硫酸中,导线上便有电流通过.

科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B、c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、c(Na+)=2c(S2-)+2c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4++H2O?NH3?H2O+H+ |
| B、S2-+2H2O?H2S+2OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、HS-+H3O+?H2S+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子积是1×10-15 |
| B、以液氨为溶剂的溶液中C(NH4+)一定等于 C(NH2-) |
| C、若液氨中放人NaNH2,其离于积不变 |
| D、此液氨中放人NH4C1,其离子积数值增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A2)=0.8mol?L-1?s-1 |
| B、v(A2)=40mol?L-1?min-1 |
| C、v(AB3)=1.0mol?L-1?s-1 |
| D、v(B2)=1.2mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
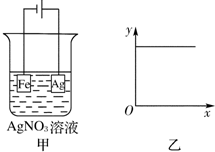 如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )
如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )| A、c(Ag+) |
| B、c(NO3-) |
| C、溶液的pH |
| D、铁片质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物 |
| B、为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液 |
| C、在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠 |
| D、用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com