
 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.| 编号 | 0.01mol/L NaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 6 | 10 | 4 | 15 | t1 |
| ② | a | 14 | 0 | 15 | t2 |
| ③ | 6 | b | c | 25 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| A、16 g甲烷分子中含有共价键的数目为2NA |
| B、常温常压下,30g葡萄糖含有的氧原子数为NA |
| C、0.1mol/L的AlCl3溶液中含有的氯离子数为0.3NA |
| D、25℃时,1L 0.1mol/L的CH3COOH溶液中的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、图 表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 |
B、图 表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
C、图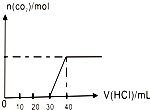 表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 |
D、图 表示向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
 |
打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |

查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 |
滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 |
滤液A中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化镁和铁分别熔化为液态 |
| B、氯化钠与氯化氢分别溶解在水中 |
| C、二氧化硅晶体与冰分别受热熔化 |
| D、碘与干冰分别受热变为气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com