
���� ������ɫ��Һ�У�˵����Cu2+��������������Һ���л�ɫ������������֪��ɫ����ΪAgI���ٵμ�ϡ���ᣬ���������ܽ⣬�������ݲ�����
������ɫ��Һ�У�ͨ����������Һ���ɫ���ٵμӵ�����Һ����Һ����ɫ��Ϊ�ⵥ�ʺ͵���������ʾ��ɫ��˵��ԭ��Һ����I-��
������ɫ��Һ�У������Ȼ�����Һ���а�ɫ�����������ٵμ�ϡ���ᣬ�������ᱵ�ܱ��������������ᱵ����������ȫ���ܽ⣬˵��һ��û��SO32-��ԭ����ΪBaCO3�������ݲ���Ϊ������̼��
��� �⣺��1����ɫ��Һһ������Cu2+��
�ٵ�һ�ݼ���AgNO3��Һ�����г������ɣ��ܺ������ӷ�Ӧ���ɰ�ɫ����������SO32- I- CO32-���л�ɫ������������ɫ����ΪAgI���϶����ڵ�������I-���ٵμ�ϡ���ᣬ���������ܽ⣬�������ݲ���������ΪAg2CO3���ܽ⣬�����������ܱ�����������������������ͬʱ����NO��
������ɫ��Һ�У�ͨ����������Һ���ɫ���ٵμӵ�����Һ����Һ����ɫ������Ϊ�ⵥ�ʺ͵���������ʾ��ɫ��˵��ԭ��Һ�϶�����I-��
������ɫ��Һ�У������Ȼ�����Һ���а�ɫ�����������ٵμ�ϡ���ᣬ�������ᱵ�ܱ��������������ᱵ����������ȫ���ܽ⣬˵��һ��û��SO32-��ԭ����ΪBaCO3���϶�����CO32-�������ݲ���Ϊ������̼���϶�������Ca2+��
���Ը���ɫ��Һ�У��϶����ڵ�������I-��CO32-���϶������ڵ�������Ca2+��Cu2+��SO32-��
�ʴ�Ϊ��I-��CO32-��Ca2+��Cu2+��SO32-��
��2����Ӧ��Ϊ̼������Ӻͱ���������̼�ᱵ��������ӦΪ��CO32-+Ba2+=BaCO3�����ٵμ�ϡ���ᣬ����ȫ���ܽ⣬Ϊ̼�ᱵ�����ᷴӦ�������ᱵ��ˮ��������̼�����ӷ�ӦΪ��BaCO3+2H+=Ba2++CO2��+H2O��
�ʴ�Ϊ��CO32-+Ba2+=BaCO3����BaCO3+2H+=Ba2++CO2��+H2O��
���� ���⿼���˳������������ӵļ��飬�漰���ӹ��桢���ӷ�Ӧ�ȶ��ǽ�����ע�����Ϣ������ʱ��Ҫϸ�·�������Ŀ�Ѷ����У�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4LH2O���еķ�����ΪNA | |
| B�� | ���³�ѹ�£�17gNH3������ԭ����ĿΪ4NA | |
| C�� | 1molNa2O2��H2O��ȫ��Ӧ��ת��2NA������ | |
| D�� | 40gNaOH�ܽ���1Lˮ�У��õ������ʵ���Ũ��Ϊ1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
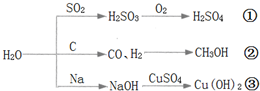
| A�� | ͼ����ʾ�ķ�Ӧ��Ϊ������ԭ��Ӧ | |
| B�� | ;������������������γɵ���Ҫ;�� | |
| C�� | ��ҵ�Ͽ���;��������ȡˮú�����ٺϳɼ״����л��� | |
| D�� | �ѽ�����Ͷ�뵽����ͭ��Һ�У�����;���۷�Ӧ����Ӧ������ͭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | VA=0.15 mol•L-1•min-1 | B�� | VB=0.6 mol•L-1•min-1 | ||
| C�� | VC=0.4 mol•L-1•min-1 | D�� | VD=0.1 mol•L-1•min-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+�������¶����߶����� | B�� | ��35��ʱ��c��H+����c��OH-�� | ||
| C�� | ����ˮ��ͨHCl��Kw���� | D�� | �¶�����������ˮ�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
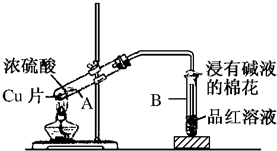
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Y
��Y ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
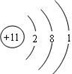 ��FԪ�������ڱ��е�λ���ǵ������ڢ�A�壻
��FԪ�������ڱ��е�λ���ǵ������ڢ�A�壻�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
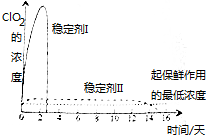 Ŀǰ���ȵ���������Cl2O��ClO2��Cl2O7�ȣ�����ClO2��Cl2���������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺���й����ݼ��±���
Ŀǰ���ȵ���������Cl2O��ClO2��Cl2O7�ȣ�����ClO2��Cl2���������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺���й����ݼ��±���| ��ѧʽ | Cl2O | ClO2 | Cl2O7 |
| �е�/�� | 3.8 | 11.0 | 82.0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com