
【题目】下列物质能与银氨溶液反应的是( )
A.葡萄糖 B.油脂 C.乙醇 D.纤维素
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列应用于原理对应不正确的是( )
A. 防毒面具—活性炭吸附有毒物质 B. 利用声呐探知海洋深度—回声定位
C. 油锅着火时用锅盖盖灭—隔绝空气 D. 船闸--流体中流速越大的位置压强越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HK | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。
若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为_________________________。
(5)设计实验证明氢氟酸比盐酸的酸性弱___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________________________
(2)倒入NaOH溶液的正确操作是______________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是______________(填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______________。
(5)______________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molL-1硫酸溶液的含义是
A. 1L水中溶解1mol硫酸
B. 将98g浓硫酸溶于水配成1L溶液
C. 1L溶液中含1mol H2SO4分子
D. 指1L硫酸溶液中溶了98g硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO![]() 、CO
、CO![]() 、SiO
、SiO![]() 、Cl-中的几种,现进行如下实验:
、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到白色沉淀。
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、Al3+、SiO![]() 、Cl-
、Cl-
B. 该溶液中一定含有K+、AlO![]() 、CO
、CO![]() 、Cl-
、Cl-
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一整套电化学装置如右图,关于该装置说法正确的是( )
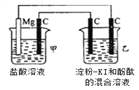
A. 甲池中Mg极为正极,电极反应式为:Mg-2e-═Mg2+
B. 甲池中C电极发生氧化反应
C. 乙池中将化学能转化为电能
D. 乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2![]() 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是( )
A. 1.0体积的N2和3.0体积的H2
B. 2.0体积的N2和6.0体积的H2和4.0体积的NH3
C. 4.0体积的NH3和1.0体积的H2
D. 2.0体积的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com