

分析 (1)①制取的气体不需要加热、难溶于水,根据提供的药品可知该气体为NO;
②用铜与稀硝酸反应制取一氧化氮气体,a为液体药品、b为固态药品,据此判断药品名称;装置甲中间的广口瓶可以除去二氧化氮气体;
③NO易于空气中的氧气反应生成二氧化氮,故不能利用排空气法收集,NO不溶于水,可以采用排水法收集,据此解答;
④铜与稀硝酸反应生成硝酸铜、一氧化氮和水,据此书写离子方程式;
(2)等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,是错误的,是因生成Cu2+的浓度相同,以此来解答;根据溶液浓度变化的影响因素和气体的溶解度影响因素解答;
(3)根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,再根据 Cu(NO3)2与NaOH 反应的关系,求出NaOH 的物质的量,最终求出NaOH溶液的体积.
解答 解:(1)①在锥形瓶中制取X气体,且不需加热、收集X气体采用排水法(说明X不溶于水),结合给出的试剂可知,制取的气体只能为NO,故答案为:NO;
②a中盛放的为液体试剂,应该为稀硝酸;b为固体,应该为铜屑;c是蒸馏水,可以将NO中混有的二氧化氮除去,
故答案为:稀硝酸;蒸馏水;
③NO易于空气中的氧气反应生成二氧化氮,故不能利用排空气法收集,NO不溶于水,可以采用排水法收集,故选择乙代替甲,故答案为:乙;
④铜与稀硝酸反应制取NO气体的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,是错误的,是因生成Cu2+的浓度相同,故答案为:不正确;铜片质量相同,生成铜离子的物质的量相同,溶液体积相同,且硝酸过量,故生成的Cu2+的浓度相同;
加热绿色溶液气体的溶解量减小,或向该绿色溶液中通入氮气,或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,都能改变溶液中溶解气体的量,故acd都正确,而加水稀释绿色溶液,由于溶液浓度变小,溶液的颜色会变化,而且加水后气体的溶解量加大,溶液的颜色也会发生变化,故不能进行判断,
故选:a、c、d;
(3)完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2=$\frac{1.68}{22.4}$mol×4
n(Cu)=0.15mol
所以 Cu(NO3)2 为0.15mol
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2=0.3 mol
则NaOH 体积V=$\frac{n}{c}$=$\frac{0.3mol}{5mol/L}$=0.06L,即60 ml,故答案为:60.
点评 本题考查了铜与稀硝酸反应的实验,题目难度中等,注意掌握常见气体的性质及制备方法,明确化学实验基本操作方法,能够正确书写常见反应的离子方程式、化学方程式,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、H+、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| B. | 氨气属于非电解质,Cu属于电解质 | |
| C. | Na2CO3溶液显碱性,说明Na2CO3属于碱 | |
| D. | 二氧化碳和二氧化硫都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 在25℃,1.01×105Pa时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
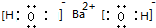 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素原子半径越大,氢化物越稳定 | |
| B. | 卤素原子半径越大,氢化物越不稳定 | |
| C. | 卤素氢化物稳定性:HF>HCl>HBr>HI | |
| D. | 卤族单质与氢气越难反应,生成的氢化物越不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
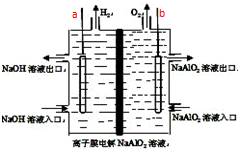 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com