
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应情况,用如图所示的装置进行有关实验。
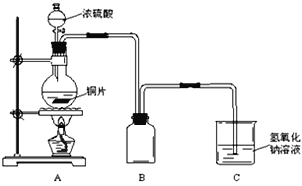
(1)装置B是用来收集实验中产生的气体的装置, 但未将导管画全,请在图中把导管补充完整__________
(2)实验中取6.4g铜片和12mL 18mol·L-1的浓硫酸分别放在圆底烧瓶和分液漏斗中,加热,直到反应结束,发现烧瓶中还有铜片剩余。该小组学生根据所学的化学知识认为还有一定量的H2SO4剩余。
①请写出铜与浓硫酸反应的化学方程式:__________
②你认为在有剩余的情况下铜片未能完全溶解的原因是__________
③下列药品能够用来证明反应结束后的烧瓶中存在余酸的是__________(填序号)。
A.铁粉 B. BaCl2溶液 C.银粉D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下实验:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度(忽略反应前后溶液体积的变化)。他认为测定SO2的量的方法有多种,下列实验方案中可行的是__________(填序号,下同),最终计算得出的余酸的物质的量浓度比实际偏高的是__________
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,反应结束后再次称量干燥管
B.用排水法测定装置A产生气体的体积
C.将装置A产生的气体缓缓通入足量稀硝酸酸化的硝酸钡溶液中,反应完全后,过滤、洗涤、干燥、称量沉淀
【答案】![]() Cu+2H2SO4(浓)
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 随着H2SO4的消耗,浓硫酸的浓度不断降低,稀硫酸与Cu不反应 AD C B
CuSO4+SO2↑+2H2O 随着H2SO4的消耗,浓硫酸的浓度不断降低,稀硫酸与Cu不反应 AD C B
【解析】
(1)依据实验产生的气体是二氧化硫与空气的密度大小比较分析,确定收集实验中产生的气体的装置中导气管的位置,收集气体时,导管长进短出;
(2)①根据铜是金属具有还原性,浓硫酸具有强氧化性,反应必须加热才能进行,注意书写化学方程式时的反应条件和浓字的书写;
②从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析;
③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,从能够与氢离子反应并且有明显现象来分析;
(3)A.碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大;
B.二氧化硫在水中以1:40溶解,收集二氧化硫体积减少;
C.二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,根据硫酸钡的质量计算二氧化硫的量。
(1)铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫比空气重,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为![]() ;
;
(2)①铜跟浓硫酸反应的化学方程式注意加热条件,书写的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
②6.4g铜片和12mL 18molL-1浓硫酸放在圆底烧瓶中共热,依据化学反应方程式的定量关系可知,0.1mol铜与含2.16mol硫酸的浓硫酸反应,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,硫酸被消耗,且产物有水生成,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但不能让铜片完全溶解;
③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子;A.铁粉与氢离子反应产生气泡,故A正确;B.BaCl2溶液只能与硫酸根产生沉淀,故B错误;C.银粉不反应,无现象,故C错误;D.Na2CO3溶液与氢离子反应产生气泡,故D正确;故答案为AD;
(3)A.碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致余酸的物质的量浓度偏低;B.二氧化硫在水中以1:40溶解,收集二氧化硫体积减少,导致余酸的物质的量浓度偏高;C.二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,根据硫酸钡的质量计算二氧化硫的量;故实验方案中可行的是C,最终计算得出的余酸的物质的量浓度比实际偏高的是B。


科目:高中化学 来源: 题型:
【题目】(题文)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I.在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)测得反应放出的热量_________92.4kJ.(填“小于”,“大于”或“等于”)
(2)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(3)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
(4)当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”、“逆向”或“不”)移动。
(5)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
II.该反应N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1_____________________,t3_____________________,t4_____________________。
(2)下列时间段中,氨的百分含量最高的是(_______)
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双环戊二烯( )主要用于制医药,农药,树脂制品,常存在于煤焦油中。下列叙述不正确的是
)主要用于制医药,农药,树脂制品,常存在于煤焦油中。下列叙述不正确的是
A. 从煤的干馏产物中可分离出苯,甲苯等基本化工原料
B. 双环戊二烯与蓝烷( )互为同分异构体
)互为同分异构体
C. 双环戊一烯能与溴的四氧化碳溶液发生取代反应
D. 双环戊一烯所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为____________;名称是________。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_______________________。
(2)若核磁共振氢谱显示链烃A中有三个峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2 mol。请回答下列问题:
(1)烃A的分子式为________。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为________________。
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为___________。
(4)比A少两个碳原子的A的烯烃同系物的同分异构体共有________种,其中只含有一个甲基的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素及其化合物在生活、生产等领域有广泛应用。
(1)从海带等富含碘的物质中提取碘的工艺步骤之一为:在稀硫酸酸化作用下.用二氧化锰氧化I-,其离子方程式为____,该反应的还原产物为______(填化学式).
(2)从海水中提取溴的过程是:向酸化的海水中通入氯气![]() 富集溴
富集溴![]() 氧化溴
氧化溴![]() 提纯溴。
提纯溴。
已知部分信息(其中a>0,b>0);
Ⅰ.H2(g)+Cl2(g)=2HCl(g)ΔH=-akJ/mol
Ⅱ.H2(g)+Br2(g)=2HBr(g)ΔH2=-bkJ/mol
Ⅲ.几种化学键的键能数据如表所示:
化学键 | H-Br | H-Cl | Cl-Cl | Br-Br |
键能/(KJ/mol) | 366 | 432 | 243 | 194 |
①酸化海水的目的是_______
②比较大小:a_____b(填“>”、“=”或“<”)
③计算2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)ΔH=_____kJ/mol(填具体数值)=_____kJ/mol (填含a,b的代数式)
(3)298K,取一定量的含Br-、Cl-的浓缩溶液。滴加稀硝酸银溶液。当生成浅黄色沉定时存在平衡: AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
A.Fe3+的消耗速率率等于Fe2+的生成速率
B.溶液的颜色保持不再变化
C.2v(I-)逆=v(I2)正
D.溶液中的c(Fe3+)=c(I-)
E.溶液中的![]() 保持不再变化
保持不再变化
(5)CuBr2是一种重要的化工原料,在密闭容器中投入足量的CuBr(s),在一定温度下发生反应:2CuBr2(s)![]() 2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
A.0.5 b.1.0 c.3.0 d.4.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),2min末生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1molL﹣1 min﹣1,试计算(写出计算过程)
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是
A. 此混合气体中可能含有乙烷
B. 此气体中一定含有甲烷
C. 此混合气体中一定不含有丙烷
D. 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是
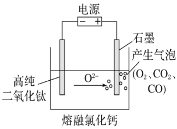
A. 阳极的电极反应式为2Cl--2e-===Cl2↑ B. 阴极的电极反应式为TiO2+4e-===Ti+2O2-
C. 通电后,O2-、Cl-均向阴极移动 D. 石墨电极的质量不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com