
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe}{→}$FeCl2$\stackrel{Zn}{→}$Fe的反应判断;
B、根据H2SO4$\stackrel{被还原}{→}$SO2$\stackrel{被氧化}{→}$SO3$\stackrel{水}{→}$H2SO4的反应判断;
C、Na[Al(OH)4]不能一步生成Al2O3,应先和酸反应Al(OH)3,Al(OH)3分解后生成Al2O3;
D、稀硝酸还原生成NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸,据此判断.
解答 解:A、铁与氯气化合生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,氯化亚铁被锌还原生成金属铁,故A正确;
B、硫酸和Cu或C等反应生成二氧化硫、二氧化硫与氧气化合生成三氧化硫,三氧化硫溶于水泥反应生成硫酸,故B正确;
C、Na[Al(OH)4]不能一步生成Al2O3,应先和酸反应Al(OH)3,Al(OH)3分解后生成Al2O3,故C错误;
D、稀硝酸还原生成NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸,故D正确,
故选C.
点评 本题主要考查的是常见物质的转化,此题利用了铁三角以及铝三角的知识,注意Al的转化中,从盐不能一步到氧化物.


科目:高中化学 来源: 题型:选择题

| A. | a口放出气体为N2 | |
| B. | 电池总反应的产物与甲醇燃烧产物一样 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3mol铜 | |
| D. | 质子将由C1电极区经交换膜向C2电极区运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
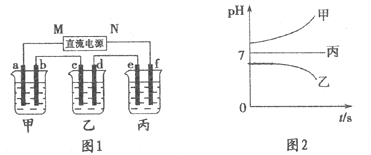
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次减少 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | Na、K、Rb的金属性依次增强 | |
| D. | N、O、F原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
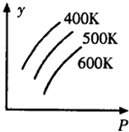
| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗时行检漏 | |
| D. | 用酒精萃取溴水中的碘单质的操作,可选用分液漏斗而后静置分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com