
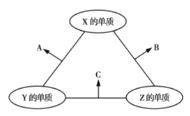
【题目】有![]() 、
、![]() 、
、![]() 三种短周期元素,其原子半径的大小顺序为
三种短周期元素,其原子半径的大小顺序为![]() ,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中
,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中![]() 为
为![]() 、
、![]() 组成的双原子分子,
组成的双原子分子,![]() 和
和![]() 均为10电子分子。下列判断错误的是( )
均为10电子分子。下列判断错误的是( )
A.![]() 的最外层电子数为6
的最外层电子数为6
B.![]() 和
和![]() 之间不可能发生氧化还原反应
之间不可能发生氧化还原反应
C.![]() 的沸点高于
的沸点高于![]() 的沸点
的沸点
D.![]() 不能溶于
不能溶于![]() 中
中
【答案】B
【解析】
B和C均为10电子分子,考虑为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质X、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系。
A. X为氧元素,属于主族元素,最外层电子数为6,处于ⅥA族,故A正确;
B. 氨气与NO可以发生反应生成氮气与水,属于氧化还原反应,故B错误;
C. 常温下,水为液体,氨气为气态,水的沸点更高,故C正确;
D. NO不溶于水,故D正确;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。某高能![]() 电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让
电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让![]() 通过,电池工作时总反应可以表示为:
通过,电池工作时总反应可以表示为:![]() 。下列说法不正确( )
。下列说法不正确( )
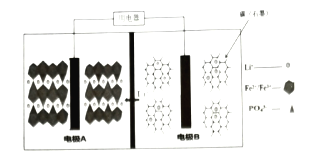
A.电池工作时,电极B为负极
B.充电时,电极A上的电势比电极B上的高
C.电池工作时,A极电极反应式:![]()
D.充电时,以铅蓄电池为电源,则电极A与![]() 电极相连
电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )

A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素的原子半径及主要化合价如下表:
元素 |
|
|
|
|
|
原子半径/ | 0.160 |
| 0.111 | 0.106 | 0.066 |
主要化合价 | +2 | +1 | +2 | +6、-2 | -2 |
下列叙述正确的是( )
A.![]() 一定是金属元素
一定是金属元素
B.原子半径大小:![]()
C.![]() 的简单氢化物的沸点比
的简单氢化物的沸点比![]() 的大
的大
D.![]() 、
、![]() 可能形成阴、阳离子个数比为
可能形成阴、阳离子个数比为![]() 的两种化合物
的两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是( )

A.正、负极的质量均减少
B.电子由AgCl经外电路流向Mg
C.AgCl电极发生氧化反应
D.该装置实现了电能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铜是制备Cu—Zn—Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:①Cu与稀硝酸反应制取,②Cu与浓硝酸反应制取,③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O。下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:
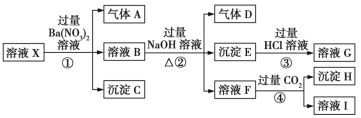
(1)沉淀C是___(填化学式),由此可确定溶液X中肯定不存在的阳离子有___。
(2)气体A是___(填化学式),产生气体A的离子方程式为___。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有___,可能存在的离子有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com