
【题目】2019年10月9日,瑞典皇家科学院宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。某高能![]() 电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让
电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让![]() 通过,电池工作时总反应可以表示为:
通过,电池工作时总反应可以表示为:![]() 。下列说法不正确( )
。下列说法不正确( )
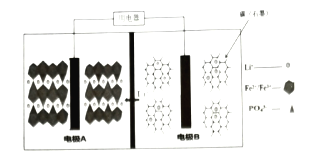
A.电池工作时,电极B为负极
B.充电时,电极A上的电势比电极B上的高
C.电池工作时,A极电极反应式:![]()
D.充电时,以铅蓄电池为电源,则电极A与![]() 电极相连
电极相连
【答案】D
【解析】
![]() →
→![]() ,该过程是化合价降低的过程,即得电子,则FePO4作氧化剂,即电极A为正极,其电极反应为:
,该过程是化合价降低的过程,即得电子,则FePO4作氧化剂,即电极A为正极,其电极反应为:![]() ;图示为电池工作的结构装置,且隔膜仅允许Li+通过,也标明了Li+的移动方向,则Li+在电极B上生成,即电极B发生
;图示为电池工作的结构装置,且隔膜仅允许Li+通过,也标明了Li+的移动方向,则Li+在电极B上生成,即电极B发生![]() →Li+的过程,该过程是失去电子的过程,则电极B作负极,其电极反应为:LixCn-xe-=xLi++Cn;据此进行作答。
→Li+的过程,该过程是失去电子的过程,则电极B作负极,其电极反应为:LixCn-xe-=xLi++Cn;据此进行作答。
A、图示为电池工作的结构装置,且隔膜仅允许Li+通过,也标明了Li+的移动方向,则Li+在电极B上生成,即电极B发生![]() →Li+的过程,该过程是失去电子的过程,则电极B作负极,A正确;
→Li+的过程,该过程是失去电子的过程,则电极B作负极,A正确;
B、充电时,电极A发生氧化反应,则电极A作阳极,即电极A与电源正极相连,则电极B与电源负极相连,电极A上的电势比电极B上的高,B正确;
C、电池工作时,A极为正极,其电极反应为:![]() ,C正确;
,C正确;
D、铅蓄电池为电源时,充电过程中,电极A与电源正极(PbO2)相连,D错误;
故选D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】向 Fe 和 Fe2O3 组成的 3.84g 混合物中加入 120mL 某浓度的盐酸,恰好完全反应,生成 672mL H2(标准状况下);向反应后的溶液中滴加几滴 KSCN 溶液,溶液无明显变化。(结果保留三位有效数字)
(1)原混合物中Fe 的质量为____________g.
(2)所用盐酸的物质的量浓度为____________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取CuCl2的生产流程如下:
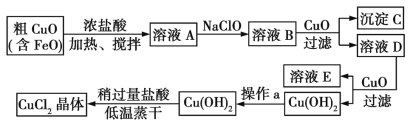
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是________________________。
(2)在溶液B中加入CuO的作用是________________________________。
(3)操作a的目的是__________________________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
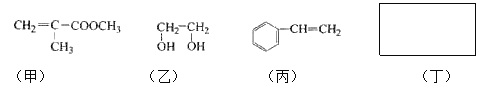
填写下列空白:
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):

A的分子式是___________,试剂X可以是___________。
(4)已知: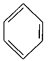 +RCl
+RCl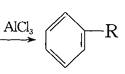 +HCl(-R为烃基)
+HCl(-R为烃基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ______________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
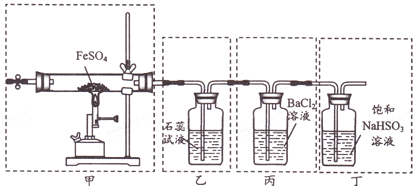
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将浓度均为
时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示,下列说法不正确的是( )
的关系如图所示,下列说法不正确的是( )
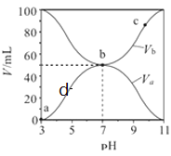
A.![]() 的数量级约为
的数量级约为![]()
B.b点时![]()
C.a、b、d几点中,水的电离程度![]()
D.![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种短周期元素,其原子半径的大小顺序为
三种短周期元素,其原子半径的大小顺序为![]() ,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中
,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中![]() 为
为![]() 、
、![]() 组成的双原子分子,
组成的双原子分子,![]() 和
和![]() 均为10电子分子。下列判断错误的是( )
均为10电子分子。下列判断错误的是( )
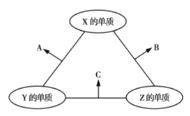
A.![]() 的最外层电子数为6
的最外层电子数为6
B.![]() 和
和![]() 之间不可能发生氧化还原反应
之间不可能发生氧化还原反应
C.![]() 的沸点高于
的沸点高于![]() 的沸点
的沸点
D.![]() 不能溶于
不能溶于![]() 中
中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com