
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
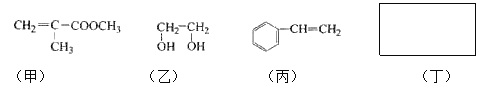
填写下列空白:
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):

A的分子式是___________,试剂X可以是___________。
(4)已知: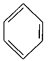 +RCl
+RCl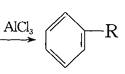 +HCl(-R为烃基)
+HCl(-R为烃基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ______________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ___________。
【答案】碳碳双键(或![]() ) ac CH2=CH-CH2-CH2-COOH C6H12O6 Br2/CCl4
) ac CH2=CH-CH2-CH2-COOH C6H12O6 Br2/CCl4 ![]() +CH3CH2Cl
+CH3CH2Cl![]() +HCl
+HCl ![]()
【解析】
(1)根据有机物甲的结构简式确定不含氧原子的官能团,有机物甲含有碳碳双键,可以与溴发生加成反应,可以被酸性高锰酸钾氧化;
(2)甲的同分异构体中不含甲基的羧酸,没有支链、碳碳双键处于碳链的一端,据此书写;
(3)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下生成苯乙烯;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,据此生成丁的结构简式。
(1)根据有机物甲的结构简式可知不含氧原子的官能团为碳碳双键,有机物甲含有C=C双键,可以与溴发生加成反应,Br2的CCl4溶液褪色,可以被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,不能使石蕊溶液褪色,故答案为ac;
(2)甲的同分异构体中不含甲基的羧酸,没有支链、碳碳双键处于碳链的一端,故符合条件的甲的同分异构体为CH2=CH-CH2-CH2-COOH;
(3)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下发生消去反应生成苯乙烯,属于取代反应的化学方程式为:![]() +CH3CH2Cl
+CH3CH2Cl![]() +HCl;
+HCl;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=110-17-76=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,故丁的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
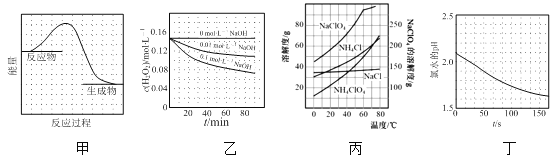
A.图甲表示某反应过程中的能量变化曲线,可推知该反应是吸热反应
B.图乙表示70℃时不同碱性条件下H2O2的浓度随时间变化的曲线,可推知溶液碱性越强,H2O2分解速率越慢
C.图丙表示部分物质的溶解度随温度变化的曲线,可推知20℃时向含a mol NaClO4的饱和溶液中加入a mol NH4Cl固体会有NH4ClO4固体析出
D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl2浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
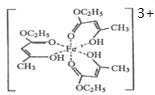
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
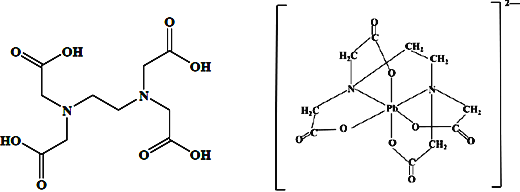
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
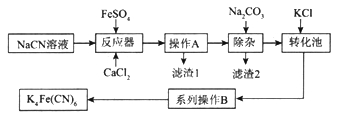
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
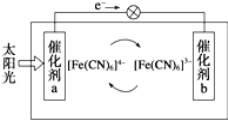
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_________________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出反应③的离子方程式:______________。
(3)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃。完全燃烧时产生的水和二氧化碳的物质的量之比为1:1。A的相对分子质量小于30。在下图变化中,中间产物C跟葡萄糖一样也能和新制的氢氧化铜反应生成砖红色沉淀。(反应条件未写出)
又知2CH3CHO+O2![]() 2CH3COOH。请回答下列问题:
2CH3COOH。请回答下列问题:
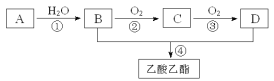
(1)写出A的名称________________________。
(2)C、D分子内含有的官能团分别是________、________(填名称)。
(3)写出下列反应的反应类型:②___________,④____________。
(4)写出下列反应的化学方程式:②____________________________________;
④____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com