
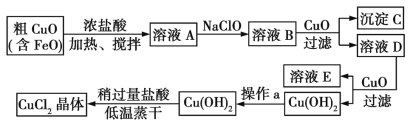
【题目】工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是________________________。
(2)在溶液B中加入CuO的作用是________________________________。
(3)操作a的目的是__________________________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是________________。
【答案】将Fe2+氧化为Fe3+,使后续分离更加完全 调节溶液的pH为3~4,使Fe3+完全转化为Fe(OH)3沉淀 洗涤Cu(OH)2表面的可溶性杂质 抑制Cu2+的水解
【解析】
由生产流程可知,加入NaClO的目的是将Fe2+氧化为Fe3+,以便在后续的生产中被除去。溶液B呈酸性,Fe3+可溶,加入的CuO可以与酸反应,提高溶液的pH,当溶液的pH为3~4时,Fe3+就会以Fe(OH)3的形式沉淀出来。过滤除去氢氧化铁,此时再加入CuO,调节溶液pH,使铜离子沉淀为氢氧化铜,过滤、洗涤沉淀得到氢氧化铜。向氢氧化铜中加入盐酸溶解生成氯化铜溶液,CuCl2溶液在蒸发结晶过程中会发生水解反应:Cu2++2H2O![]() Cu(OH)2+2H+,加入盐酸和采用低温可抑制Cu2+水解,从而得到较高纯度的产品。
Cu(OH)2+2H+,加入盐酸和采用低温可抑制Cu2+水解,从而得到较高纯度的产品。
(1)根据表格中的溶度积可知,Fe3+比Fe2+更易水解形成Fe(OH)3沉淀,加入NaClO的目的是将Fe2+氧化为Fe3+,使后续分离更加完全;
(2)粗氧化铜采用浓盐酸浸渍,此时浸渍液为强酸性,加入的CuO可以与酸反应,提高溶液的pH,当溶液的pH为3~4时,Fe3+就会以Fe(OH)3的形式沉淀出来;
(3)过滤得到的Cu(OH)2表面有可溶性杂质,应以适量蒸馏水洗去;
(4)CuCl2溶液在蒸发结晶过程中铜离子会发生水解反应:Cu2++2H2O![]() Cu(OH)2+2H+,加入盐酸可抑制Cu2+水解,水解反应为吸热反应,采用低温抑制Cu2+水解,从而得到较高纯度的产品。
Cu(OH)2+2H+,加入盐酸可抑制Cu2+水解,水解反应为吸热反应,采用低温抑制Cu2+水解,从而得到较高纯度的产品。


科目:高中化学 来源: 题型:
【题目】(1)从绿色化学、环保的角度选择制取硫酸铜的原料________。
a.Cu b.CuO
c.CuS d.Cu(OH)2·CuSO4
(2)写出从硫酸铜溶液中得到硫酸铜晶体的操作:________、________、过滤、洗涤……
(3)如图球形管装置的作用:_________________________________________。
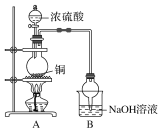
(4)反应后溶液中存在Cu2+,但浓硫酸有吸水性,不能通过溶液颜色来判断Cu2+的存在,请写出一种简便的方法验证Cu2+的存在:_________________________________________________________________。
(5)在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体。
已知:2CuS![]() Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
(6)根据以上信息,说明Cu与浓硫酸反应需要控制哪些因素:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:

下列说法错误的是
A. 装置I烧瓶中放入的药品X为铜屑
B. 装置II中用“多孔球泡”可增大SO2的吸收速率
C. 装置III用于吸收未反应的SO2
D. 用装置II反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是
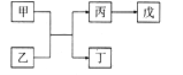
A. C、D两元素形成化合物属共价化合物
B. C和E形成的化合物的水溶液呈碱性
C. 简单离子半径D > B > C
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭的真空容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是( )
CaO(s)+CO2(g),达到平衡,下列说法正确的是( )
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的压强不变
B.该反应的△H<0
C.将碳酸钙粉碎进行反应可以提高碳酸钙的转化率
D.保持压强不变,充入He,再次达到平衡时,CaO的质量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。某高能![]() 电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让
电池,多应用于公共交通。电池工作时结构如图所示,电池中间是聚合物的隔膜,主要作用是在反应过程中只让![]() 通过,电池工作时总反应可以表示为:
通过,电池工作时总反应可以表示为:![]() 。下列说法不正确( )
。下列说法不正确( )
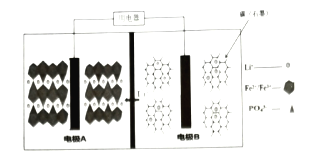
A.电池工作时,电极B为负极
B.充电时,电极A上的电势比电极B上的高
C.电池工作时,A极电极反应式:![]()
D.充电时,以铅蓄电池为电源,则电极A与![]() 电极相连
电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com