
��֪298 K��101 kPa�����£�
��4Al(s)��3O2(g)=2Al2O3(s) ��H����2834.9 kJ��mol��1
��4Al(s)��2O3(g)=2Al2O3(s) ��H����3119.1 kJ��mol��1
�ɴ˵ó�����ȷ�����ǣ� ��
| A����������O2��O3�����ͣ���O2��ΪO3Ϊ���ȷ�Ӧ |
| B��O3��O2�ȶ�����O2��ΪO3Ϊ���ȷ�Ӧ |
| C��O2��O3�ȶ�����O2��ΪO3Ϊ���ȷ�Ӧ |
| D����������O2��O3�����ͣ���O2��ΪO3Ϊ���ȷ�Ӧ |
D
���������������֪25�桢101kpa�����£�
��1��4Al��s��+302��g���T2Al2O3��s������H=-2834.9kJ��mol��1
��2��4Al��s��+2O3��g���T2Al2O3��s������H=-3119.1KJ��mol��1
���ݸ�˹���ɣ�1��-��2���õ���3O2��g���T2O3��g����H=-2834.9kJ��mol��1-��-3119.1KJ��mol��1��=284.1KJ��mol��1��A������ת��Ϊ���������ȷ�Ӧ��3mol��������2mol�������յ�����284.2kJ��A����B����������O2��O3�������ͣ�����O2��O3�ȶ���B����C����O2��ΪO3�Ļ�ѧ��ӦΪ���ȷ�Ӧ��C����D����������O2��O3�����ͣ���O2��ΪO3Ϊ���ȷ�Ӧ��D��ȷ��ѡD��
���㣺��ѧ�������ܵ��ת������Ӧ�Ⱥ��ʱ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����и�˵���У���ȷ����
| A����H >0��ʾ���ȷ�Ӧ����H <0��ʾ���ȷ�Ӧ |
| B��1mol H2SO4��1mol Ba(0H)2��Ӧ����BaSO4����ʱ�ų����Ƚ����к��� |
| C��1mol H2��0.5mol O2��Ӧ�ų����Ⱦ���H2��ȼ���� |
| D���Ȼ�ѧ����ʽ�еĻ�ѧ������ֻ��ʾ���ʵ����������Ƿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪���з�Ӧ���Ȼ�ѧ����ʽ
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ��H1
2 H2(g)+ O2(g) 2H2O(g) ��H2
C(s)+ O2(g) CO2(g) ��H3
��Ӧ4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)�Ħ�HΪ
| A��12��H3+5��H2��2��H1 | B��2��H1��5��H2��12��H3 |
| C��12��H3��5��H2��2��H1 | D����H1��5��H2��12��H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
Ϊ�˲ⶨ����кͷ�Ӧ���к��ȣ�����ʱ������Ҫ��������
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧ����Һ������
������ˮ�����ʵ��� ��Ӧǰ����Һ�¶ȱ仯 �߲��������ʱ��
| A���٢ڢۢ� | B���٢ۢܢ� | C���ۢܢݢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
SF6��һ�������ľ�Ե���壬���ӽṹ�д���S-F������֪S8(s)�ķ��ӽṹģ�ͣ���ͼ��������1molS��S��1molF��F ��1molS��F�������յ������ֱ�Ϊ280kJ ��160kJ��330kJ.�� ���ķ�Ӧ�Ȧ�HΪ �� ��
���ķ�Ӧ�Ȧ�HΪ �� ��
| A��-1780kJ��mol��1 | B��-1220kJ��mol��1 | C��-450kJ��mol��1 | D��+430kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й����Ȼ�ѧ��Ӧ����������ȷ����
| A��HCl��NaOH��Ӧ���к��ȡ�H����57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к��ȡ�H��2��(��57.3)kJ/mol |
| B��1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ���� |
| C����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ |
| D��CO(g)��ȼ������283.0kJ/mol����2CO2(g) ��2CO(g)��O2(g)��Ӧ�ġ�H��2��283.0kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪����H2(g) �� 0.5O2(g) ��H2O(g) ��H1��a kJ/mol�� ��2H2(g) �� O2(g) �� 2H2O(g)��H2��b kJ/mol����H2(g) �� 0.5O2(g) ��H2O(l) ��H3��c kJ/mol
��2H2(g) �� O2(g) �� 2H2O(l) ��H4��d kJ/mol�����й�ϵʽ����ȷ����
| A��a��c��0 | B��b��d��0 | C��2a��b��0 | D��2c��d��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ijһ��ѧ��Ӧ�ڲ�ͬ�����µ������仯������ͼ��ʾ������˵����ȷ����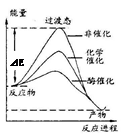
| A����ѧ����ø����Ч���� |
| B��ʹ�ò�ͬ�������Ըı䷴Ӧ����ЧӦ |
| C��ʹ�ò�ͬ�������Ըı䷴Ӧ���ܺ� |
| D����Ӧ�������������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
| A����֪2H2(g)��O2(g)=2H2O(g)��H=��483.6 kJ��mol��1����������ȼ���ȣ���H��Ϊ��241.8 kJ��mol��1 |
| B����֪NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)��H=��57.3 kJ��mol��1����40.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�С��57.3kJ������ |
| C����֪2C(s)��2O2(g)=2CO2(g)��H = a��2C(s)��O2(g)=2CO(g)����H = b����a��b |
| D����֪C (ʯī��s)="C" (���ʯ��s)��H��0����ʯī�Ƚ��ʯ�ȶ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com