
已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:单选题
已知充分燃烧a g乙炔(C2H2)气体时生成1 mol CO2气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1 |
B.C2H2(g)+ O2(g)=2CO2(g)+H2O(l)ΔH=2b kJ·mol-1 O2(g)=2CO2(g)+H2O(l)ΔH=2b kJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-b kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知(1)H2(g)+ O2(g)=H2O(g); DH1=akJ·mol-1
O2(g)=H2O(g); DH1=akJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g) ; DH2=b kJ·mol-1
(3)H2(g)+ O2(g)=H2O(l) ; DH3=c kJ·mol-1
O2(g)=H2O(l) ; DH3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l) ; DH4=d kJ·mol-1
下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A+B→C(△H>0)分两步进行:①A+B→X(△H<0),②X→C(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
| A.Q1< Q2 |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图为反应2X(g)+Y(s)  2Z(g)的反应过程和能量关系图,下列说法正确的是( )
2Z(g)的反应过程和能量关系图,下列说法正确的是( )
| A.曲线a和b表示两个反应过程的反应热不同 |
| B.曲线a一定表示反应是在无催化剂时的反应过程 |
| C.增大压强,X的转化率一定增大 |
| D.反应达到平衡后,升高温度,平衡常数K值一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是: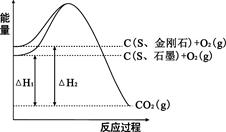
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
| A.等质量的O2比O3能量低,由O2变为O3为放热反应 |
| B.O3比O2稳定,由O2变为O3为吸热反应 |
| C.O2比O3稳定,由O2变为O3为放热反应 |
| D.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
由金红石(TiO2)制取单质Ti涉及到的步骤为:
TiO2 TiCl4
TiCl4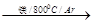 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) DH=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH是
| A.-80kJ·mol-1 | B.-160kJ·mol-1 | C.160kJ·mol-1 | D.80kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com