
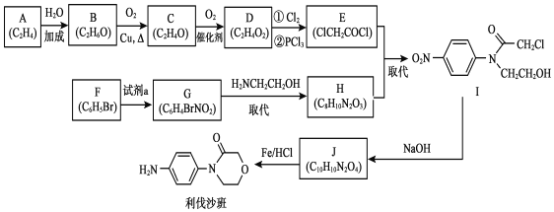
【题目】药物利伐沙班临床主要用于预防髋或膝关节置换术患者静脉血栓栓塞。药物利伐沙班的合成路线如下:
已知:R—X+![]()
![]()
![]() +HX (R代表烃基)
+HX (R代表烃基)
(1)B→C 的化学方程式是___________。
(2)C→D 的反应类型是________。
(3)F 的结构简式是_________。
(4)F→G 所需的试剂a 是____________。
(5)G→H 的化学方程式是____________。
(6)以![]() 为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。
为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。

(7)J制备利伐沙班时,J发生了还原反应,同时生成了水,则J与HCl物质的量之比为__________。
【答案】2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应 ![]() 浓HNO3、浓H2SO4
浓HNO3、浓H2SO4 ![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr
+HBr ![]()
 1:6
1:6
【解析】
A为CH2=CH2,和水发生加成反应生成B,B为CH3CH2OH,B发生催化氧化生成C,C为CH3CHO,C发生氧化反应生成D,D为CH3COOH,D发生取代反应生成E,E与H发生取代反应生成I,根据E、I确定H为![]() 。G发生取代反应生成H,故G为
。G发生取代反应生成H,故G为![]() ;由F分子式得F为
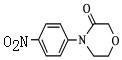
;由F分子式得F为![]() ,F和浓硝酸发生取代反应生成G,J发生还原反应生成利伐沙班,则J为
,F和浓硝酸发生取代反应生成G,J发生还原反应生成利伐沙班,则J为 ,I脱去1分子HCl成环得到J。
,I脱去1分子HCl成环得到J。
(1)B为CH3CH2OH,B发生催化氧化生成C为CH3CHO,B→C 的化学方程式是2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)C为乙醛、D为乙酸,乙醛发生催化氧化生成乙酸,C→D的反应类型是氧化反应;
故答案为:氧化反应;
(3)G为![]() ,结合F的分子式,可知F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,故F的结构简式是
,结合F的分子式,可知F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,故F的结构简式是![]() ;
;
故答案为:![]() ;
;
(4)F和浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成G,F→G所需的试剂a是浓HNO3、浓H2SO4;
故答案为:浓HNO3、浓H2SO4;
(5)G→H 的化学方程式是![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr;
+HBr;
故答案为:![]() +H2NCH2CH2OH
+H2NCH2CH2OH![]()
![]() +HBr;
+HBr;
(6)以![]() 为原料,加入ClCH2CH2OCH2COCl发生取代反应生成
为原料,加入ClCH2CH2OCH2COCl发生取代反应生成![]() ,然后发生取代反应生成
,然后发生取代反应生成 ,补充完整为:
,补充完整为: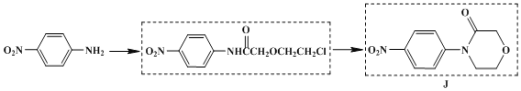 ;
;
故答案为: ;
;
(7)J制备利伐沙班时,J发生了还原反应,硝基转化为氨基,同时生成了水,1molJ 反应生成2 mol H2O,引入1mol-NH2,由H原子守恒可知需要HCl为6mol,故J与HCl物质的量之比为1:6,故答案为:1:6。


科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备CuSO4·5H2O的部分实验步骤如图:
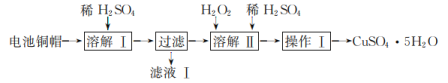
下列说法错误的是( )
A.“溶解I”中,为加快溶解速率,可将铜帽粉碎
B.“滤液I”中,溶质的主要成分为ZnSO4
C.“溶解II”过程中,有大量的气体产生
D.“操作I”需要用到酒精灯玻璃棒等仪器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
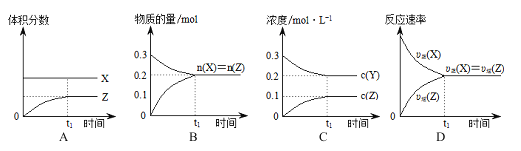
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
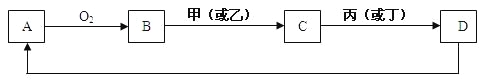
试回答:
(1) 写出B在工业生产中的一种用途___________________。
(2)写出B转化为C的可能的离子方程式____________________________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理_______________。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为________mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式_______________________;若负极材料消耗18g,则电池转移的电子总数为_________。 (阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
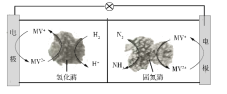
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域。以下为镁的两种冶炼方法。
Ⅰ.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3·MgCO3)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO·MgO),然后在还原炉中经1 200 ℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示。
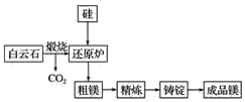
(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式:_______________。
Ⅱ.海水综合利用可以制备金属镁,其流程如下图所示:
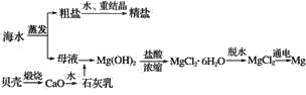
(2)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是___________________________。
(3)综合比较两种方法,皮江法的缺点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
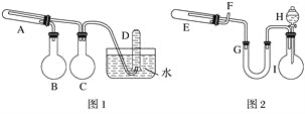
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是____________;烧瓶C的作用是__________;在试管D中收集得到的是__________。
(2)实验时,U形管G中应加入的试剂是____________;长颈漏斗H中应加入____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________________。
(4)试管E中发生反应的化学方程式是__________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须____________;E管中的反应开始后,在F出口处应________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com