
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
试回答:
(1) 写出B在工业生产中的一种用途___________________。
(2)写出B转化为C的可能的离子方程式____________________________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理_______________。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为________mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式_______________________;若负极材料消耗18g,则电池转移的电子总数为_________。 (阿伏加德罗常数用NA表示)
【答案】工业上制备Al(或作耐火材料) Al2O3+6H+=2Al3++3H2O Al2O3+2OH—+3H2O = 2[Al(OH)4]— 或
Al2O3+2OH—=AlO2–+H2O Al3++3H2O![]() Al(OH)3(胶体)+3H+ (4m-n)/3mol O2+2H2O+4e—=4OH— 2NA
Al(OH)3(胶体)+3H+ (4m-n)/3mol O2+2H2O+4e—=4OH— 2NA
【解析】
由题意:A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可知B为Al2O3,则A为Al、C为Al(OH)3,
(1)氧化铝可以制备Al(或作耐火材料)等;
(2)B转化生成C为氧化铝与强碱或强酸的反应;
(3)若C的溶液显酸性,则C为铝盐,溶液中铝离子水解生成氢氧化铝胶体,可以净水;
(4)若C为钠盐,甲为NaOH,C为NaAlO2,根据 AlO2-+H2O+H+=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O计算剩余的氢氧化铝的物质的量;
(5)Al为负极、铂电极为正极,氧气在正极获得电子生成氢氧根离子;根据Al元素化合价变化计算转移电子数目.
由题意:A是单质,与氧气反应生成B为氧化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应,为酸与碱的反应,甲与丁为同类物质,丙与乙为同类物质,氧化物B能与酸或碱反应生成C,D是A单质所含元素的最高价氧化物的水化物,结合转化关系,可推知B为Al2O3,则A为Al、C为Al(OH)3,,则:
(1)Al2O3在工业上制备Al(或作耐火材料);
(2)B转化生成C为氧化铝与强碱或强酸的反应,反应离子方程式为:Al2O3+6H+=2Al3++3H2O 或Al2O3+2OH-=2AlO2-+H2O,Al2O3+2OH—+3H2O = 2[Al(OH)4]—;
(3)若C的溶液显酸性,C为铝盐,溶液中铝离子水解Al3++3H2O![]() Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以净水;
Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以净水;
(4)若C为钠盐,甲为NaOH,C为NaAlO2,1L n mol·L-1的盐酸中n(HCl)=n mol,由于n(NaAlO2):n(HCl)=1:2,故按AlO2-+H2O+H+=Al(OH)3↓反应,盐酸有剩余,能部分溶解氢氧化铝,则:
AlO2-+H2O+H+=Al(OH)3↓
m mol m mol m mol
剩余n(H+)=n mol-m mol=(n-m)mol
Al(OH)3+3H+=Al3++3H2O
(n-m)/3mol (n-m)mol
得到氢氧化铝沉淀为:m mol-(n-m)/3mol=(4m-n)/3mol;
(5)Al为负极、铂电极为正极,氧气在正极得电子生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,18gAl的物质的量,n(Al)=18g/27g·mol-1=2/3mol,故转移电子数目=2/3mol×3×NAmol-1=2NA.


科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学中四种常见的物质,其转化关系如图所示。则甲和丁可能是
![]()
①N2和O2 ②C12和Fe ③C和O2 ④SO2和NaOH溶液
A.①②B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
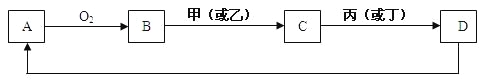
【题目】某课外活动小组同学用下图装置进行实验,试回答下列问题:
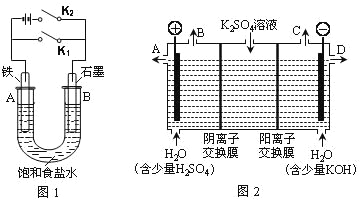
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为_________(填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
①U型管里总反应的离子方程式为______________________________________
②对于上述实验,下列说法正确的是________(填序号)。
A.溶液中Na+向B极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D. 若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为___________________________。此时通过阴离子交换膜的离子数_____(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口___(填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物利伐沙班临床主要用于预防髋或膝关节置换术患者静脉血栓栓塞。药物利伐沙班的合成路线如下:
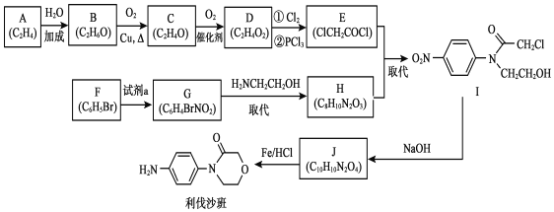
已知:R—X+![]()
![]()
![]() +HX (R代表烃基)
+HX (R代表烃基)
(1)B→C 的化学方程式是___________。
(2)C→D 的反应类型是________。
(3)F 的结构简式是_________。
(4)F→G 所需的试剂a 是____________。
(5)G→H 的化学方程式是____________。
(6)以![]() 为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。
为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。

(7)J制备利伐沙班时,J发生了还原反应,同时生成了水,则J与HCl物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了图中的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置略去)。
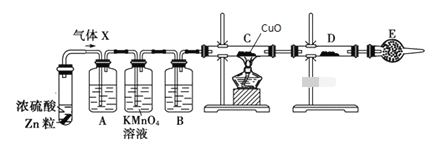
试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为__________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)A中加入的试剂可能是______,作用是__________;B中加入的试剂可能是__________,作用是_______;E中加入的试剂可能是__________,作用是__________。
(4)可以证明气体X中含有氢气的实验现象:C中__________,D中__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com