
【题目】已知甲、乙、丙、丁是中学化学中四种常见的物质,其转化关系如图所示。则甲和丁可能是
![]()
①N2和O2 ②C12和Fe ③C和O2 ④SO2和NaOH溶液
A.①②B.①②③C.②③④D.①②③④
【答案】C
【解析】
从图可知,甲与丁反应生成乙,乙进一步与丁反应生成丙,丙又能与甲生成乙,此为与量或反应条件等有关的物质转化关系,可结合每组物质的性质进行逐个分析。
①若甲和丁为N2和O2,N2和O2在放电条件下反应生成NO,NO与O2反应生成NO2,但NO2无法与N2反应生成NO,转化关系错误;
②若甲和丁为Cl2和Fe,氯气和铁点燃反应生成氯化铁,氯化铁溶液与铁反应生成氯化亚铁,氯化亚铁溶液与氯气反应生成氯化铁,转化关系正确;
③若甲和丁为C和O2,氧气与碳反应生成二氧化碳,二氧化碳与碳在高温条件下反应生成一氧化碳,一氧化碳与氧气反应生成二氧化碳,转化关系正确;
④若甲和丁为SO2和NaOH溶液,二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,亚硫酸氢钠与氢氧化钠反应生成亚硫酸钠和水,转化关系正确;
所以符合题意的是②③④;
答案选C。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
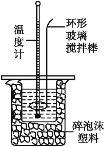
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的恒容密闭容器中,通入4mol A和5mol B,发生反应:4A(g)+5B(g)=3C(g)+3D(s)。5min后压强变为原来的80%,则该反应在0~5min内的平均反应速率可表示为
A.v(A)=0.24 mol·L-1·min-1B.v(B)=0.15 mol·L-1·min-1
C.v(C)=0.18 mol·L-1·min-1D.v(D)=0.36 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A.金属钠加入CuSO4溶液中:![]()
B.金属铝加入NaOH溶液中:![]()
C.铁粉加入FeC13溶液中:![]()
D.铜片插入浓HNO3溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备CuSO4·5H2O的部分实验步骤如图:
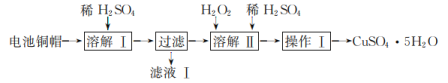
下列说法错误的是( )
A.“溶解I”中,为加快溶解速率,可将铜帽粉碎
B.“滤液I”中,溶质的主要成分为ZnSO4
C.“溶解II”过程中,有大量的气体产生
D.“操作I”需要用到酒精灯玻璃棒等仪器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
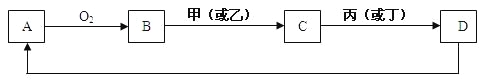
试回答:
(1) 写出B在工业生产中的一种用途___________________。
(2)写出B转化为C的可能的离子方程式____________________________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理_______________。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为________mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式_______________________;若负极材料消耗18g,则电池转移的电子总数为_________。 (阿伏加德罗常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com