
����Ŀ����2L�ĺ����ܱ������У�ͨ��4mol A��5mol B��������Ӧ��4A(g)��5B(g)��3C(g)��3D(s)��5min��ѹǿ��Ϊԭ����80%����÷�Ӧ��0��5min�ڵ�ƽ����Ӧ���ʿɱ�ʾΪ
A.v(A)��0.24 mol��L��1��min��1B.v(B)��0.15 mol��L��1��min��1
C.v(C)��0.18 mol��L��1��min��1D.v(D)��0.36 mol��L��1��min��1
���𰸡�B
��������
��������ʽ��֪����A��ת����Ϊx����
4A(g)��5B(g)��3C(g)��3D(s)
��ʼʱŨ�ȣ�mol��4 5 0
�ı��Ũ�ȣ�mol��4x 5x 3x
ƽ��ʱŨ�ȣ�mol��4-4x 5-5x 3x
ѹǿ֮�ȵ������ʵ���֮�ȣ���![]() =80%��
=80%��
���x=0.3����÷�Ӧ��0��5min��A����4x=1.2mol��
v(A)=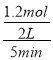 =0.12 mol��L��1��min��1��
=0.12 mol��L��1��min��1��
v(B)=![]() v(A)=0.15mol��L��1��min��1��
v(A)=0.15mol��L��1��min��1��
v(C)=![]() v(A)=0.09mol��L��1��min��1��
v(A)=0.09mol��L��1��min��1��
DΪ���壬Ũ��Ϊ�����������ڱ�ʾ��ѧ��Ӧ���ʡ�
��ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϴ�����[��Co(OH)3��Fe(OH)3��]�л����ܵ����ַ������£�
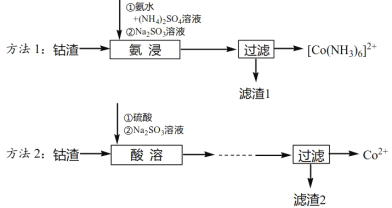
��֪��
��Ksp[Co(OH)3]=1.6��10-44��Ksp[Co(OH)2]=6.3��10-15��Ksp[Fe(OH)3]=4.0��10-38��
�ڼ��������£�Fe(OH)3�����������Ʒ�Ӧ��Fe3++NH3������������Co2+��Co3+����λ��ѧ��Ӧ��
��ش��������⣺
(1)����1��������ʱ�õİ�ˮ�������ٷ���Ϊa���ܶ�Ϊ��g��cm-3���ð�ˮ�����ʵ���Ũ��Ϊ_____mol��L-1���������������з�����Ӧ�����ӷ���ʽΪ_______��
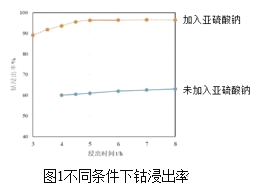
(2)����1��������ʱ��δ��Na2SO3��Һ�ͼ���Na2SO3��Һʱ���ܽ�������ͼ1��ʾ�����������������ܽ����ʲ�ͬ��ԭ��______��
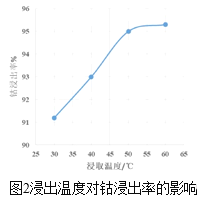
(3)����1�У������¶ȶ��ܽ����ʵ�Ӱ����ͼ2��ʾ����ҵ��ѡ��50�������Ǹ����¶ȵĿ��ܵ�ԭ����_____��
(4)����2�У�Ϊ����������ʣ��ɲ�ȡ�Ĵ�ʩ��______(д��һ������)��
(5)�Աȷ���1�ͷ���2�������ʷ���ĽǶȷ�������1���ŵ���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ��Ϊ�����������Ĵ������㷺ʹ�ã���ѧС�������·����ⶨij��84����Һ������Ч�ȵĺ�����
I.ȷ��ȡ2.00mL����Һϡ�ͳ�100.0mL��Һ��
II.ȡ1.00mL����ϡ�ͺ���Һ�����μ���3mol��L-1������Һ15mL��15.00mLһ��Ũ�ȵ�Fe2+��Һ���Ӹ���ҡ���Ⱥ����¾��÷�Ӧ10min��
III.��0.0010mol��L-1�ı�K2Cr2O7��Һ�ζ�II�з�Ӧ����Һ����¼���ĵ����ΪVmL��
IV.��ȡ��II����ͬ��15.00mLһ��Ũ�ȵ�Fe2+��Һ�����μ���1.00mL����ˮ��3mol��L-1������Һ15mL���Ӹ���ҡ���ȣ�
V.��0.0010mol��L-1�ı�K2Cr2O7��Һ�ζ�IV����Һ����¼���ĵ����ΪV0mL��
(1)��ҵ����ȡ��84����Һ����Ӧ�Ļ�ѧ����ʽΪ_______��
(2)����ϡ����Һ�õ��IJ����������ձ�������������ͷ�ιܺ�______��
(3)��KSCN��Һ��II��Ӧ����Һ�к���Fe3+��������______�����з�Ӧ�����ӷ���ʽΪ______��
(4)���з�����Ӧ�����ӷ���ʽ��_____(Cr2O![]() ת��ΪCr3+���������²�����Cl-)��
ת��ΪCr3+���������²�����Cl-)��
(5)����84����Һ������Ч�ȵĺ���Ϊ_____ g/100mL��(��Ч����NaClO�����ƣ�NaClOĦ��������74.5g��mol-1)
(6)����Fe2+����_____�ԣ�II��IV��ʵ�������ܱ������н��С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������[Ce(OH)4]��һ����Ҫ��ϡ���������ƽ�������ʾ�����������л���������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2)��ij�������Դ˷�ĩΪԭ�ϻ����棬���ʵ���������£�
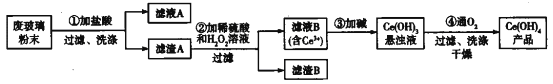
����˵���������
A. ����A����Ҫ����SiO2��CeO2
B. ���˲������õ��IJ����������ձ���©����������
C. ���̢��з�����Ӧ�����ӷ���ʽΪCeO2+H2O2+3H+=Ce3++2H2O+O2��
D. ���̢������� 11.2L O2(���ۺϳɱ�״��)��ת�Ƶ�����Ϊ2��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��������ʵ�����A��B�������2 L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() mC(g)��2D(g)������5 min��Ӧ�ﵽƽ�⡣��ʱ��ã�D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��1��3��C�ķ�Ӧ������0.1 mol��L��1��min��1����
mC(g)��2D(g)������5 min��Ӧ�ﵽƽ�⡣��ʱ��ã�D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��1��3��C�ķ�Ӧ������0.1 mol��L��1��min��1����
��m��ֵΪ���٣�_____________
��A��5 minĩ��Ũ�ȡ�__________
��B��ƽ��ת���ʡ�___________
�ܸ÷�Ӧ��ƽ�ⳣ����___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����������ѧ��ѧ�����ֳ��������ʣ���ת����ϵ��ͼ��ʾ����Ͷ�������
![]()
��N2��O2 ��C12��Fe ��C��O2 ��SO2��NaOH��Һ
A.�٢�B.�٢ڢ�C.�ڢۢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaN3�����������ײʱ�����ķ�ӦΪ��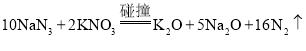 ������1 mol N2���ɣ��������ж���ȷ����
������1 mol N2���ɣ��������ж���ȷ����
A.����N2�����һ��Ϊ22.4 LB.��0. 125 mol KNO3������
C.Na2OΪ�������N2Ϊ��ԭ����D.ת�Ƶ��ӵ����ʵ���Ϊ0.625 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ��������������Ч����֮һ����1L�ĺ����ܱ������г���2mol NH3��1mol NO��1mol NO2��������Ӧ��2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g)��H���ڲ�ͬ�¶��·���������Ӧ�����N2�����ʵ���(mol)��ʱ��Ĺ�ϵ���±���
2N2(g)��3H2O(g)��H���ڲ�ͬ�¶��·���������Ӧ�����N2�����ʵ���(mol)��ʱ��Ĺ�ϵ���±���
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
�ش��������⣺
(1)������Ӧ��___________(����ĸ)��
A. ��S>0����H>0 B. ��S>0����H<0 C. ��S<0����H>0 D. ��S<0����H<0
(2)T1_______(����>����<����������)T2��������___________________________________________
(3)T1K�£�0��20min��v(NO)��______________
(4)T2K�£�NO2��ƽ��ת����Ϊ_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6mol X�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��2X��g��+Y��g��=nM��g��+2W��g��2min ĩ������֪��W ��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05molL��1min��1������������������ʵ����뷴Ӧǰ����������������ʵ���֮��Ϊ5��4����
��1��ǰ2min����Y��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ___________��
��2��2minĩʱX��Ũ��Ϊ_________��
��3����ѧ��Ӧ����ʽ��n��ֵ��____________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com