
【题目】“84消毒液”为含氯消毒剂的代表被广泛使用,化学小组用如下方法测定某“84消毒液”中有效氯的含量。
I.准确量取2.00mL消毒液稀释成100.0mL溶液;
II.取1.00mL上述稀释后溶液,依次加入3mol·L-1硫酸溶液15mL、15.00mL一定浓度的Fe2+溶液,加盖振摇混匀后,室温静置反应10min;
III.用0.0010mol·L-1的标准K2Cr2O7溶液滴定II中反应后溶液,记录消耗的体积为VmL;
IV.另取与II中相同的15.00mL一定浓度的Fe2+溶液,依次加入1.00mL蒸馏水、3mol·L-1硫酸溶液15mL,加盖振摇混匀;
V.用0.0010mol·L-1的标准K2Cr2O7溶液滴定IV中溶液,记录消耗的体积为V0mL。
(1)工业上制取“84消毒液”反应的化学方程式为_______。
(2)Ⅰ中稀释溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______。
(3)用KSCN溶液检测到II反应后溶液中含有Fe3+的现象是______,Ⅱ中反应的离子方程式为______。
(4)Ⅲ中发生反应的离子方程式是_____(Cr2O![]() 转化为Cr3+,此条件下不氧化Cl-)。
转化为Cr3+,此条件下不氧化Cl-)。
(5)该“84消毒液”中有效氯的含量为_____ g/100mL。(有效氯以NaClO质量计,NaClO摩尔质量:74.5g·mol-1)
(6)由于Fe2+具有_____性,II、IV中实验须在密闭容器中进行。
【答案】Cl2+2NaOH=NaCl+NaClO+H2O 100mL容量瓶 溶液变成血红色 2H++ClO-+2Fe2+=Cl-+2Fe3++H2O ![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O 1.1175(V0-V)或1.1(V0-V) 还原
+6Fe2++14H+=6Fe3++2Cr3++7H2O 1.1175(V0-V)或1.1(V0-V) 还原
【解析】
结合工业用氯气和氢氧化钠制取“84消毒液”书写化学反应方程式,根据氧化还原反应规律书写Ⅱ、Ⅲ步骤中的离子反应方程式,结合方程式及关系式法进行相关计算。
(1)“84消毒液”的主要成分为NaClO,工业上用氯气和氢氧化钠制取,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)Ⅰ中稀释溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL的容量瓶,故答案为:100mL的容量瓶;
(3)Fe3+遇到KSCNf发生反应Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3为血红色,因此用KSCN溶液检测到II反应后溶液中含有Fe3+的现象是溶液变成血红色,反应Ⅱ中Fe2+被ClO-在酸性条件下氧化为Fe3+,反应的离子方程式为2H++ClO-+2Fe2+=Cl-+2Fe3++H2O,故答案为:溶液变成血红色;2H++ClO-+2Fe2+=Cl-+2Fe3++H2O;
(4)Ⅲ中剩下的Fe2+被K2Cr2O7氧化为Fe3+,Cr2O![]() 转化为Cr3+,此条件下不氧化Cl-,则反应的离子方程式为
转化为Cr3+,此条件下不氧化Cl-,则反应的离子方程式为![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:
+6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O;
+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(5)由Ⅰ、Ⅱ、Ⅲ可知,消毒液中的ClO-氧化了部分Fe2+,剩余的Fe2+用K2Cr2O7标准溶液滴定,消耗体积为VmL。由IV、V可知,全部的Fe2+用K2Cr2O7标准溶液滴定,消耗体积为V0mL。所以被ClO-氧化的n(Fe2+)=6×10-3 mol·L-1×(V0-V)×10-3 L×102=6×10-4(V0-V)mol,根据(3)问中所写方程式,有2Fe2+~ClO-,所以n(NaClO)=3×10-4(V0-V)mol,故有效氯含量=74.5g·mol-1×3×10-4(V0-V) mol÷2 mL×100 mL=1.1175(V0-V)g≈1.1(V0-V),故答案为:1.1175(V0-V)或1.1(V0-V);
(6)由于Fe2+具有还原性,易被空气中的氧气氧化,因此II、IV中实验须在密闭容器中进行,故答案为:还原。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:
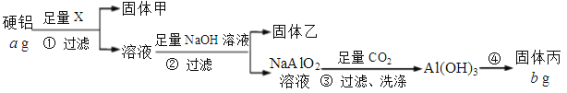
(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:
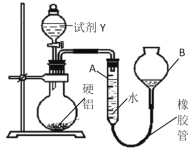
操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中医药是中华民族的瑰宝,厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是( )
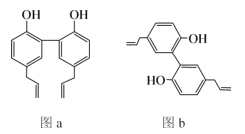
A.厚朴酚与溴可发生加成反应或取代反应
B.图b所示为厚朴酚的一种同分异构体
C.厚朴酚分子中所有碳原子可能共平面
D.1mol厚朴酚最多可跟8molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下趣味化学实验:
将HgCl2溶液和KIO3溶液同时加入 | 反应原理: ①IO ②IO ③Hg2++2I-=HgI2↓(橙红色) |
现象:先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色 |
下列说法不正确的是( )
A.反应①中IO![]() 表现了氧化性
表现了氧化性
B.反应①对反应②的进行有促进作用
C.该实验条件下,反应速率:③>②
D.用Na2SO3溶液代替NaHSO3进行实验,现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ (X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. υ(NH3)=0.0100mol·L-1·s-1B. υ(O2)=0.0010 mol·L-1·s-1
C. υ(NO)=0.0010 mol·L-1·s-1D. υ(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,在元素周期表中的位置如图所示,其中W元素的原子序数为Z元素原子序数的两倍,则下列说法正确的是
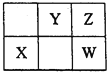
A. X位于元素周期表中的第3周期第ⅥA族
B. X、Y、Z三种元素对应原子的半径依次减小
C. XZ2和YZ2的结构和化学性质相似
D. 利用Y的含氧酸酸性强于W的含氧酸酸性,可证明非金属性W强于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的恒容密闭容器中,通入4mol A和5mol B,发生反应:4A(g)+5B(g)=3C(g)+3D(s)。5min后压强变为原来的80%,则该反应在0~5min内的平均反应速率可表示为
A.v(A)=0.24 mol·L-1·min-1B.v(B)=0.15 mol·L-1·min-1
C.v(C)=0.18 mol·L-1·min-1D.v(D)=0.36 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com