
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(2)根据碱性溶液盛放在碱式滴定管中;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据关系式HCl~NaOH来计算,再求出NaOH的质量和质量分数.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取),冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以试验除了需要250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒;
故答案为:玻璃棒;
(2)烧碱显碱性,故需要用碱式滴定管量取烧碱溶液;
故答案为:碱;
(3)滴定前溶液为红色,滴定终点时溶液为无色,所以滴定终点现象为滴最后一滴溶液由红色变为无色,半分钟不褪色;
故答案为:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色;
(4)A.滴定前平视,滴定后俯视,造成V(标准)偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏小,烧碱纯度偏小,故A不选;
B.未用标准液润洗滴定管,标准液浓度减小,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故B选;
C.用待测液润洗锥形瓶,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故C选确;
D.不小心将标准液滴在锥形瓶外面,造成V(标准)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故D选;
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,操作正确,不产生误差,故E不选;
F.滴定前尖嘴有气泡,滴定后消失,则标准溶液的体积偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,可知c(待测)偏大,烧碱纯度偏大,故F选;
故答案为:BCDF;
(5)所耗盐酸标准液的体积分别为:19.90mL,20.10mL,两组数据均有效,盐酸标准液的平均体积为20.00mL;
HCl~~~~~~~NaOH
1 1
0.2000mol/L×20.00mL C(NaOH)×10mL
解得:c(NaOH)=0.4mol/L,则500mL的溶液中含有NaOH的质量为:0.4mol/L×0.50L×40g/mol=8.0g,烧碱样品的纯度为$\frac{8.0g}{8.8g}$×100%=91%;
故答案为:91.
点评 本题考查了物质含量的测定,主要考查了溶液的配制、酸碱中和滴定的操作、数据处理和物质含量的计算等,题目难度中等,掌握中和滴定的原理是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
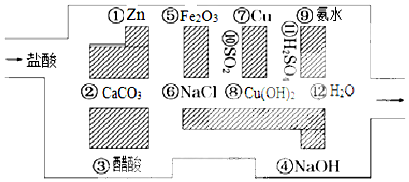
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.
某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 试验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出| 锥形瓶中的液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| ① | 碱 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 碱 | 酚酞 | (甲) |
| ③ | 碱 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 碱 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
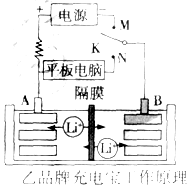 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com