
【题目】按要求完成下列填空
Ⅰ.已知: ① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=___________________________________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0
① 下列事实能说明该反应达到平衡的是___________(填序号)
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式_________________。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
____SiO2 + C + N2![]() Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
【答案】-2219.9 kJ/mol b d 0.5 CO-2e-+ CO32-===2CO2 3 6 2 1 6 28 g/mol AC
【解析】
(1)由① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l)ΔH=-2741.8 kJ/mol ② 2CO(g) + O2(g) ===2CO2(g)ΔH=-566 kJ/mol。根据盖斯定律可以知道,![]() 可得(1)反应C3H8(g) + 5O2(g) =3CO2(g) + 4H2O(l)的ΔH=,其反应热为[-2741.8 kJ/mo +(-566 kJ/mol)
可得(1)反应C3H8(g) + 5O2(g) =3CO2(g) + 4H2O(l)的ΔH=,其反应热为[-2741.8 kJ/mo +(-566 kJ/mol)![]() /2=-2219.9 kJ/mol ;因此答案是: -2219.9 kJ/mol。
/2=-2219.9 kJ/mol ;因此答案是: -2219.9 kJ/mol。
(2)①a.由反应可以知道,反应前后的压强始终不变,则体系中的压强不发生变化,不能判断平衡,故a错误; b.υ正(H2)=υ逆(CO),正反应速率等于逆反应速率,达到平衡,故b正确;c.气体的总质量不变,总物质的量不发生变化,不能判断平衡,故c错误;d.CO2的浓度不再发生变化,由平衡的特征“定”可以知道,则化学反应达到平衡,故d正确;因此答案是:bd;
②C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,所以起始有CO2,根据元素守恒可以知道, c(CO)=1 mol/L, c(H2O)=2.4 mol/L,二氧化碳为0.8mol/L,达到平衡后,CO的转化率为60%,则CO的浓度变化量=1 mol/L![]() =0.6mol,则
=0.6mol,则
CO(g) + H2O(g)![]() CO2(g) + H2(g)
CO2(g) + H2(g)
开始(mol/L ): 1 2.4 0 0
变化(mol/L ) : 0.6 0.6 0.6 0.6
平衡(mol/L ): 0.4 1.8 0.6 0.6
平衡常数K=0.6![]() /0.6
/0.6![]() 0.6=0.5;答案是:0.5
0.6=0.5;答案是:0.5
Ⅱ.负极失电子化合价升高,且根据电解质溶液知负极反应方程式为CO-2e-+ CO32-===2CO2;答案:CO-2e-+ CO32-===2CO2。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得,根据化合价升降守恒以及元素守恒定律配平方程式得:
3SiO2 +6C +2N2![]() Si3N4 + 6CO 答案: 3 6 2 1 6
Si3N4 + 6CO 答案: 3 6 2 1 6
(2)剩余的气体为N2、CO,两气体的摩尔质量均为28 g/mol,则混合气体的摩尔质量亦为28 g/mol;答案:28 g/mol。
(3)A.氮化硅具有很大的发展前景,可以在冶金工业上制成坩埚、铝电解槽衬里等设备,故A正确;B.电子没有传递的通道,所以不能导电,故B错误;C.氮化硅的结构与金刚石相似,也是原子晶体,硬度超过金刚石,可以替代同类型的金属设备,故C正确;D.氮化硅的制造材料并不缺乏,硅是地壳含量第二高元素,氮是空气中含量最高的元素,因此开发不会受到资源的限制,故D错误;正确答案为AC。


科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。


下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的![]() 倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列物质时,会出现丁达尔效应的是:①消毒用的酒精 ②Fe(OH)3胶体 ③生理食盐水 ④有色玻璃 ⑤云、雾
A.②④⑤B.③④⑤C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
A. 体系的压强保持不变
B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变
D. 每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应中,属于氧化还原反应的是
A.Cu2++2OH-= Cu(OH)2↓B.H++OH- =H2O
C.2H++CO32-=H2O+CO2↑D.Cu2++Fe=Fe2++ Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为bkJ/mol
C. 2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D. 当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
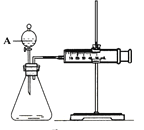
【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:
时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
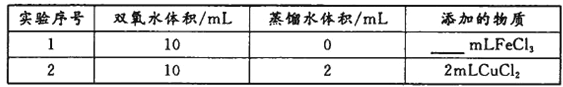
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
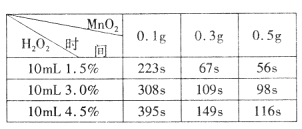
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
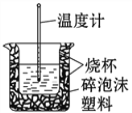
请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com