
分析 根据n=cV计算原硫酸铜溶液中硫酸铜的物质的量,硫酸溶液中硫酸的物质的量,
(1)根据c=$\frac{n}{V}$计算混合溶液中CuSO4的物质的量浓度;
(2)计算硫酸根的总的物质的量,再根据c=$\frac{n}{V}$计算混合溶液中SO42-的物质的量浓度.
解答 解:混合前:n( CuSO4)=2.0mol/L×0.1L=0.2mol,n(H2SO4)=l.0mol/L×0.1L=0.1mol.
(1)混合后溶液的体积为0.2L,c(CuSO4)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:混合溶液中CuSO4的物质的量浓度为1mol/L;
(2)混合后:n(SO42-)=n( CuSO4)+n(H2SO4)=0.2mol+0.1mol=0.3mol,混合后c(SO42-)=$\frac{0.3mol}{0.2L}$=1.5mol/L;
答:混合溶液中SO42-的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的相关计算,题目难度不大,注意相关计算公式的运用.


科目:高中化学 来源: 题型:实验题
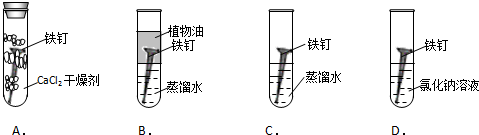
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
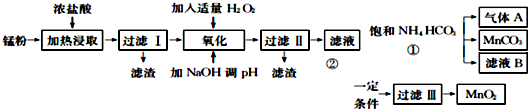
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
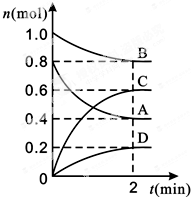 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
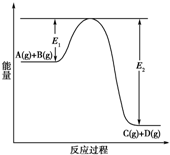 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如下图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com