
| A、H2SO4=H2++SO42- |
| B、Ba(OH)2=Ba2++OH- |
| C、NaNO3=Na++NO3- |
| D、MgSO4═Mg+2+SO4-2 |


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑥ | B、①③⑥⑦ |
| C、②④⑤⑧ | D、②⑤⑦⑧ |
查看答案和解析>>
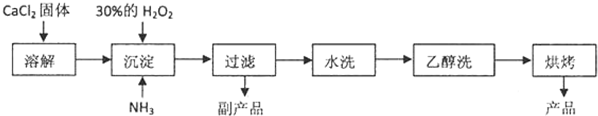
科目:高中化学 来源: 题型:
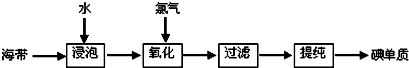
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
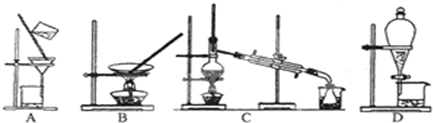
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、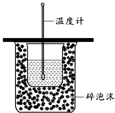 用如图装置测定中和热 |
| B、中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化 |
| C、研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 |
| D、测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为了节约火柴,用燃着的酒精灯引燃另一盏酒精灯 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水的大 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、蒸馏操作时,应使用温度计水银球应放到溶液中测量溶液的温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com