
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
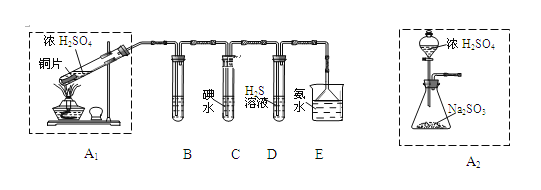
①装置A1中发生反应的化学方程式为_______;
②装置B用于检验SO2的漂白性,其中所盛试剂为_____,装置D用于检验SO2的_______性质;
③装置C中反应的离子方程式为_____;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写一点即可)_____________________;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体、实验在标准状况下测定)。
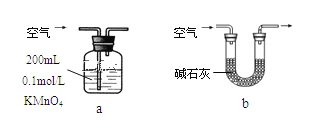
你认为哪个装置可行(填序号)______,使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____________________________;
【答案】Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑ 品红溶液 氧化性 SO2+I2+2H2O=SO42-+2I-+4H+ 不用加热(或节约能源、节约药品或易于控制反应进行,反应更充分) a 当KMnO4溶液刚褪色时,测定通入空气的体积V
CuSO4+2H2O+SO2↑ 品红溶液 氧化性 SO2+I2+2H2O=SO42-+2I-+4H+ 不用加热(或节约能源、节约药品或易于控制反应进行,反应更充分) a 当KMnO4溶液刚褪色时,测定通入空气的体积V
【解析】
(1)①装置A1中Cu与浓硫酸共热发生反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
②SO2有漂白性,在装置B用品红溶液检验二氧化硫;二氧化硫与硫化氢发生反应SO2+2H2S=3S↓+H2O,反应中SO2是氧化剂,表现氧化性;
③装置C中SO2与碘水发生反应I2+SO2+2H2O=H2SO4+2HI,据此写出反应的离子方程式;
④使用装置A2的优点是不用加热,可以节约能源,相对安全,易于控制反应进行,反应更充分等;
(2)二氧化硫能够被酸性KMnO4溶液氧化,可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。
(1)①在装置A1中Cu与浓硫酸共热发生反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
②装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性,在装置B用品红溶液检验;在装置D中发生反应:SO2+2H2S=3S↓+H2O,反应中SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性;
③在装置C中SO2与碘水发生反应:I2+SO2+2H2O=H2SO4+2HI,反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;易于控制反应进行;反应更充分等;
(2)①将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
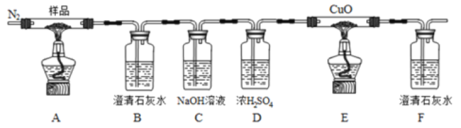
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+C12![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2= CH2+ C12![]()
![]()
C.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-和ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
A.21∶5B.11∶3C.3∶1D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
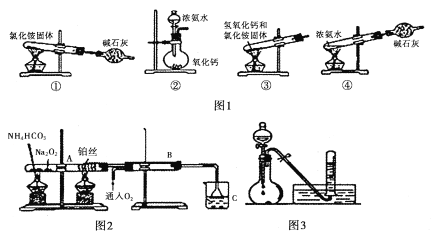
I. (1)图1为制取氨气的装置和选用的试剂,其中合理的是______________(填字母)。
A,①② B. ②③ C. ②④ D. ①③
(2)实验室制备氨气的化学方程式是____________________________________。
II. 图2位铵盐的受热分解装置
(1)被加热的铂丝处发生反应的化学方程式为____________________________________。
(2)B中出现的现象为_______________________________________________________。
(3)如图3:将上述烧杯C中反应得到酸的足量的浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.7g食盐与10g98%浓硫酸混合加热。求:
(1)在微热条件下反应,生成HCl气体在常温常压下的体积_______________(已知常温常压下气体摩尔体积为24L/mol。)
(2)将生成的HCl全部溶于100g水中,所得盐酸的质量百分比浓度_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):

已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.124g的P4含有P-P键的数目为6NA
B.15.6g的苯含有σ键的数目为1.2NA
C.2.24L的乙炔含有π键的数目为0.2NA
D.60g的SiO2中含有Si-O键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种白色晶体,有与石墨相似的层状结构,层内的H3BO3分子通过氢键相连(如图所示)。H3BO3在冷水中溶解度较小,可溶于热水,在水中的解离反应为:H3BO3+H2O![]() H++B(OH)4-。下列有关说法中正确的是( )
H++B(OH)4-。下列有关说法中正确的是( )

A.正硼酸晶体属于原子晶体
B.H3BO3和B(OH)4-中B原子杂化轨道的类型都为sp2
C.H3BO3是三元弱酸
D.含1molH3BO3的晶体中含有3mol氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com