
【题目】下列说法不正确的是![]()
![]()
A.卤代烃在NaOH醇溶液中的反应与苯和硝酸反应生成硝基苯的反应类型不相同
B.工业上选择往石灰乳中通氯气来制漂白粉
C.甲苯和裂化汽油可用酸性高锰酸钾溶液鉴别
D.纯碱溶液去油污的原理是油脂在碱性条件下发生水解
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
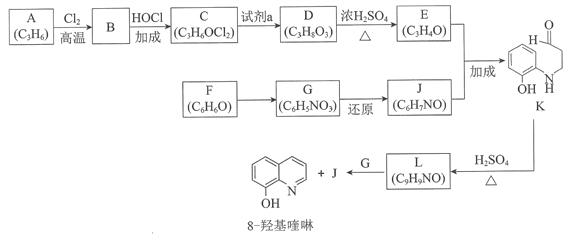
已知:i. 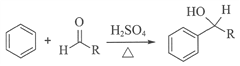
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________
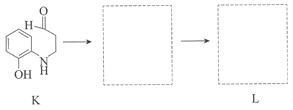
(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物CH3﹣CH=CH﹣C≡C﹣CF3分子结构的叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.有5个碳原子可能在一条直线上
C.6个碳原子一定都在同一平面上
D.6个碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
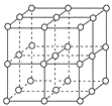
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图______________。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有________个。
(3)在NaCl晶胞中正六面体的顶角上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于________,即________(填计算式);Na+的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子间的距离为____________________________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池(俗称干电池)在生活中的用量很大。其中普通锌锰电池的构造图如右图所示。回答下列问题:
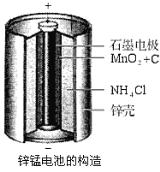
(1)电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,正极发生的主要反应是________________________。
(2)下图表示从废旧普通锌锰电池除去锌壳和电极后的内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
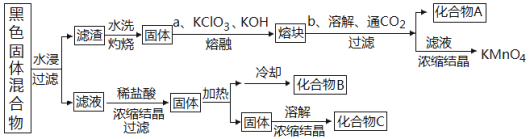
①黑色固体混合物水浸时为提高浸出速率,常采用的措施为________________(答两条);得到滤液加入稀盐酸的作用为__________________。
②滤渣水洗灼烧后固体主要成份只有一种,操作a中得到熔块的主要成分是K2MnO4,该过程中发生反应的化学方程式为:_____________________________。
③图中产物的化学式分别为:A__________、B_________。
(3)准确称量得到的KMnO4(不含能与草酸反应的杂质)3.160 g,放入小烧杯中,加水溶解后转移到200mL容量瓶中定容,在锥形瓶中用差量法称取0.6700 g无水草酸钠,加入足量硫酸溶液溶解,加热至75~80℃。用已配制好的KMnO4溶液进行滴定,消耗溶液体积为22.50mL。
已知Mr(Na2C2O4)=134 Mr(KMnO4)=158
①判断滴定终点的现象是__________________。
②KMnO4的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列相关说法正确的是( )
A.密闭容器中反应aA(g)+bY(g)![]() cZ(g)达到平衡,T0时改变某一条件变化如图
cZ(g)达到平衡,T0时改变某一条件变化如图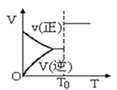 ,则改变的条件只能是加入催化剂
,则改变的条件只能是加入催化剂
B.反应L(s)+aG(g)![]() bR(g)达到平衡时,外界条件对平衡影响关系如图
bR(g)达到平衡时,外界条件对平衡影响关系如图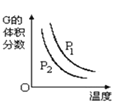 ,则正反应为放热反应,且a>b
,则正反应为放热反应,且a>b
C.其它条件相同时,物质的量和温度关系如图所示 ,则反应aA+bB
,则反应aA+bB![]() cC的正反应为放热反应
cC的正反应为放热反应
D.反应速率和反应条件变化关系如图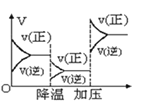 ,则反应A+2B
,则反应A+2B![]() 2C+3D的正反应为放热反应,且A、B、C、D均为气体
2C+3D的正反应为放热反应,且A、B、C、D均为气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com