
【题目】已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一平面上的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. 
【答案】D
【解析】
在常见的有机化合物中甲烷是正四面体结构,则甲基或亚甲基所有原子不可能共平面,乙烯和苯是平面型结构,结合已知给出的甲醛分子共平面进行判断。
A. 苯为平面结构,乙烯为平面结构,通过旋转乙烯基连接苯环的单键,可以使两个平面共面,故苯乙烯中所有的原子可能处于同一平面,故A项不选;
B. 旋转羧基中的C-O单键,可以使羧基中的所有原子处于同一平面,通过旋转羧基连接苯环的单键,可以使两个平面共面,故苯甲酸中所有的原子可能处于同一平面,故B项不选;
C. 苯环为平面结构,醛基为平面结构,通过旋转醛基连接苯环的单键,可以使两个平面共面,故苯甲醛中所有的原子可能处于同一平面,故C项不选;
D. 分子中存在甲基,具有甲烷的四面体结构,所有原子不可能处于同一平面,故D项符合题意;
答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】A.《化学与生活》
(1)为减轻大气污染、遏制火灾隐患,今年扬州市区全面禁燃烟花爆竹。据市环境监测中心提供的数据显示,春节禁放期间,AQI(空气质量指数)改善明显,空气质量明显优于去年同期。
①“禁止燃放烟花爆竹”的标识是_____。

②AQI评价的主要污染物为PM2.5、_____、二氧化硫、二氧化氮、臭氧、一氧化碳。
③扬州市2月6日至2月11日空气质量如表,结合表判断扬州空气质量等级达优的有_____天。
AQI | 0~50 | 51~100 | 101~150 | 151~200 |
空气质量等级 | 优 | 良 | 轻微污染 | 轻度污染 |
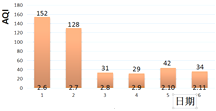
④燃放烟花爆竹时不仅会造成噪音污染,而且会释放出大量的有毒有害气体,如SO2、NO2等,产生空气污染。SO2和NO2可以在一定条件下反应生成NO和另一种氧化物,造成二次空气污染。写出该反应的化学方程式_____。
(2)“蒌蒿满地芦芽短,正是河豚欲上时”是扬州春天真实的写照。
①蒌蒿清香、鲜美,脆嫩爽口,含有丰富的维生素C、维生素A、钙、铁等。其中属于人体所需微量元素的是_____(填元素符号)。
②蒌蒿中含有的维生素A属于_____维生素(填“水溶性”或“脂溶性”)。
③河豚肉质鲜美,蛋白质丰富。蛋白质在人体内水解的最终产物是_____。
(3)2018年10月,世界上最长的跨海大桥—港珠澳大桥正式开通,创造多项世界之最。

①港珠澳大桥采用了世界首创深插式钢圆筒快速成岛技术。深埋在海水中的钢圆筒易发生_____腐蚀,下列保护钢圆筒的措施不合理的是_____(填字母)
a.采用铜质扣件固定保护
b.使用抗腐蚀性强的合金
c.在钢管表面喷镀环氧乙烷树脂镀层
②港珠澳大桥使用了世界最大尺寸高阻尼橡胶隔震支座。为使橡胶性能更好,天然橡胶需要_____处理以增强其机械性能。
③世界首创主动止水的海底沉管隧道使用的超级抗裂钢筋混凝土属于_____(填字母)。
a.金属材料 b.有机高分子材料 c.复合材料
④港珠澳大桥全线夜景照明全部采用LED光源。LED光源与传统光源比较,其优点有_____。(写一种)
⑤港珠澳大桥钢结构混凝土预制件吊装采用超高分子质量聚乙烯(UHMWPE)纤维,是目前世界上强度最高的纤维。请写出由乙烯合成聚乙烯的化学方程式:_____。
B.《有机化学基础》
(1)根据分子中所含官能团可预测有机化合物的性质。
① 测定某有机物的相对分子质量,常用的方法是_____(填字母)。
a.质谱法 b.燃烧法 c.核磁共振氢谱法
② 下列有机物中核磁共振氢谱只有1个峰的是_____(填字母)。
a.甲苯 b.新戊烷 c.乙醚
③ 1mol下列物质完全燃烧时,消耗5mol O2的是_____(填字母)。
a.乙炔 b.丁烷 c.乙酸乙酯
(2)咖啡酸具有止血、镇咳、祛痰等疗效,其结构为:
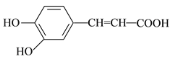
①咖啡酸分子中的含氧官能团的名称为_____、_____。
②有关咖啡酸性质的叙述错误的是_____。
a.在浓硫酸、加热条件下能发生消去反应
b.既能和浓溴水发生加成反应也能发生取代反应
c.能与酸性高锰酸钾溶液反应
d.1 mol 咖啡酸在一定条件下最多能与4 mol 2发生加成反应
(3)四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的一种合成路线(部分试剂及反应条件省略):
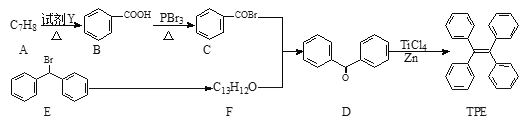
①A的结构简式为_____。
②A![]() B的反应类型为_____反应;E
B的反应类型为_____反应;E![]() F的反应类型为_____反应。
F的反应类型为_____反应。
③生成D的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
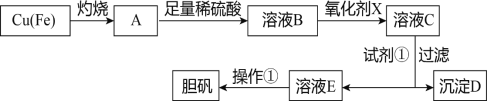
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.7 | 7.5 | 4.4 |
完全沉淀 | 3.7 | 9.7 | 6.7 |
请回答:
(1)溶液B中含有的阳离子有____________________(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__________(填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,要调整pH范围是_____________,则试剂①可以选择______________(填化学式)。
(4)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是____________________________________(用离子方程式表示)。
(5)溶液E经过操作①可得到胆矾,操作①为________________________、过滤、洗涤。
(6)已知溶液中c(Cu2+)与pH的关系为lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1mol/L,此时溶液中的Fe3+能否沉淀完全:___________(填“能”或“否”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A. 《化学与生活》

(1) 营养均衡是保证健康的重要方面。某种食品的配料标签如图所示,根据该食品的配料填空。
①该食品配料中,富含糖类的物质是____。
②该食品配料中,苯甲酸钠的作用是____。
③该食品配料中,碳酸氢钠的作用是____。
(2) 材料是社会经济发展的物质基础。
①钢铁在生活中的应用十分广泛,在潮湿的空气中容易发生____腐蚀。
②普通玻璃的主要成分是Na2SiO3、CaSiO3和 ____(填化学式)。____(填化学式)对玻璃有腐蚀作用,可用于在玻璃仪器上标注刻度及文字。
③聚氯乙烯塑料的结构简式为________,玻璃钢属于________(填“无机非金属材料”“功能高分子材料”或“复合材料”)。
(3)化学与技术的发展是解决环境问题的有效路径。
①减少燃煤产生气体SO2的排放,能够有效控制______(填“硝酸型酸雨”“硫酸型酸雨”或“光化学烟雾”)的形成;向燃煤中加入适量的____(填名称)可减少燃煤烟气中的SO2排放。
②燃煤产生的CO2用氨水吸收可得到氮肥碳铵(NH4HCO3),写出该反应的化学方程式______________。工业上通常采用沉淀法除去废水中的重金属离子,需要控制废水的_____使重金属离子以氢氧化物的形式沉淀出来。
③工业上采用将CO在500 ℃、铝矾催化作用下还原SO2,反应得到两种产物,其中一种产物在常温下是固体。该项技术可大大降低燃煤烟气中SO2的含量,反应的化学方程式为____________________。
B.《有机化学基础》
(1) 有机物的结构决定了其所具有的性质。
①下列有机物不溶于水的是____(填字母)。
a. 乙醛 b. 乙醇 c. 乙酸乙酯
②下列化合物中,不能与新制氢氧化铜悬浊液反应的是____(填字母)。
a. 福尔马林 b. 乙烯 c. 乙酸
③下列试剂中,可用于鉴别苯和甲苯的是____(填字母)。
a. 水 b. 溴水 c. 酸性KMnO4溶液
(2)水杨酸是一种柳树皮提取物,是天然的消炎药,其结构为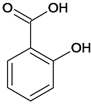 。
。
①水杨酸苯环上的一氯代物有____种。
②水杨酸需密闭保存,其原因是__________。
③水杨酸与足量NaHCO3溶液反应,所得有机产物的结构简式为______。
(3)化合物C是一种医药中间体,由甲苯制备化合物C的路线如下:
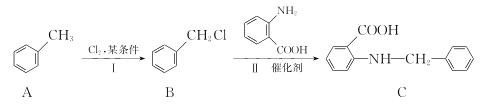
①A→B的反应类型是____。
②B分子中化学环境不同的氢原子有____种。
③D是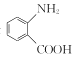 的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
的一种同分异构体,D分子中只有一种官能团,苯环上的一氯代物有2种。则D的结构简式为________。
④B→C的反应中能生成化合物E,E和C的相对分子质量相同,写出生成化合物E的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池在生活中的用量很大。酸性锌锰电池(干电池)和碱性锌锰电池的构造如图所示。下列有关说法错误的是( )
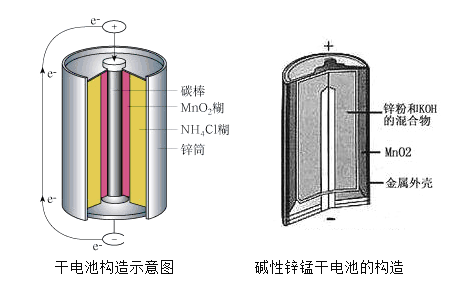
A. 二者分别消耗6.5g锌,都将转移0.2mol电子
B. 二者的正极反应式均为![]()
C. 碱性锌锰电池比酸性锌锰电池比能量高
D. 酸性锌锰电池易发生漏液现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com