
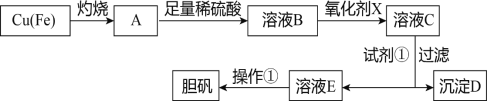
【题目】下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.7 | 7.5 | 4.4 |
完全沉淀 | 3.7 | 9.7 | 6.7 |
请回答:
(1)溶液B中含有的阳离子有____________________(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__________(填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,要调整pH范围是_____________,则试剂①可以选择______________(填化学式)。
(4)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是____________________________________(用离子方程式表示)。
(5)溶液E经过操作①可得到胆矾,操作①为________________________、过滤、洗涤。
(6)已知溶液中c(Cu2+)与pH的关系为lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1mol/L,此时溶液中的Fe3+能否沉淀完全:___________(填“能”或“否”) 。
【答案】Cu2+、Fe2+、Fe3+、H+ b 3.7 ~4.4 CuO【或Cu(OH)2或CuCO3】 Fe+2Fe3+=3Fe2+ 蒸发浓缩、冷却结晶 能
【解析】
灼烧废铜屑,Cu反应生成CuO、Fe被氧化生成Fe3O4,A的成分为CuO、Fe3O4,A与足量稀硫酸反应生成CuSO4、FeSO4、Fe2(SO4)3,B中含有CuSO4、FeSO4、Fe2(SO4)3和稀硫酸,加入氧化剂X得到溶液C,X能氧化亚铁离子生成铁离子但是不能引进新的杂质,则X为H2O2,加入试剂①是为了调节pH,加入的物质能和氢离子反应但是不能引进新的杂质,过滤得到的沉淀D为Fe(OH)3,溶液E为CuSO4,从溶液中蒸发浓缩、冷却结晶、过滤得到胆矾,据此解答。
(1)A中含有CuO、Fe3O4,A和稀硫酸反应且稀硫酸过量导致溶液B中含有CuSO4、FeSO4、Fe2(SO4)3和稀硫酸,所以B中含有阳离子为Cu2+、Fe2+、Fe3+、H+;
(2)氧化剂X能氧化亚铁离子生成铁离子且不能引进新的杂质,双氧水被还原为水,不引进新的杂质,但是次氯酸钠和高锰酸钾溶液能引进新的杂质,所以选双氧水,故答案为b;
(3)加入试剂①是为了调节pH,试剂①能和氢离子反应且不能引进新的杂质,该试剂为CuO或Cu(OH)2或CuCO3,由于是沉淀铁离子,而不沉淀铜离子,所以根据表中数据可知要调整pH范围是3.7~4.4;
(4)亚铁离子不稳定,易被空气氧化生成铁离子,因此实验室保存FeCl2溶液,需加入过量的铁粉,反应的离子方程式为Fe+2Fe3+=3Fe2+;
(5)溶液E为硫酸铜,硫酸铜溶液经过操作①可得到胆矾,由于硫酸铜易溶于水,则操作①为蒸发浓缩、冷却结晶、过滤洗涤;
(6)已知溶液中c(Cu2+)与pH的关系为lgc(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1mol/L,则此时溶液的pH=(8.6-lg1)÷2=4.3>3.7,所以溶液中的Fe3+能沉淀完全。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】以Pt-g-C3N4为催化剂,用光催化氧化法脱除NO的过程如图所示。
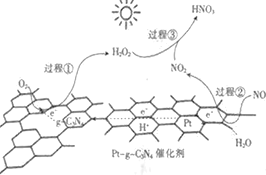
该脱除过程中,下列说法不正确的是
A. 该过程为太阳能转化为化学能
B. Pt端发生的是氧化反应
C. 过程①发生的电极反应为H2O2-2e-=O2↑+2H+
D. 过生③的化学方程式为2NO2+H2O2=2HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用I2O5可使CO与H2O(g)反应转化为CO2和H2,从而有效减少大气污染。该过程可通过图1所示的两步反应循环实现。
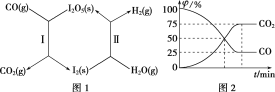
其中:反应Ⅰ为I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反应Ⅱ中,生成1 mol H2(g)时,反应热ΔH=b kJ·mol-1。
①总反应的热化学方程式为(反应热ΔH用含a、b的代数式表示)______。
②在恒温密闭容器中加入一定量的CO(g)和I2O5(s),发生反应Ⅰ并达到平衡。测得体系中各气体组分的体积分数φ随时间t的变化如图2所示。则此反应用气体分压表示的平衡常数Kp=______(已知:气体分压=气体总压×体积分数)。
(2)已知铅盐中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS难溶于水,室温下其溶度积常数为Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①将一定量的PbSO4加入足量饱和CH3COONH4溶液中,微热,并不断搅拌,因发生复分解反应,PbSO4缓慢溶解。能发生此复分解反应的原因是______。
②某溶液中主要含有S2-、SO42-等阴离子,向其中滴加Pb(NO3)2溶液,当PbSO4开始析出时,溶液中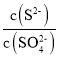 =________。
=________。
(3)钛基二氧化铅(Ti/PbO2)是重要的电极材料,工业上用电解法制作,主要流程如图:
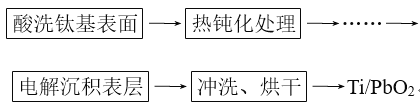
其中“电解沉积表层”是制作的关键,方法是电解可溶性铅盐溶液,使生成的PbO2沉积在阳极金属钛(Ti)上。主反应为2Pb2++2H2O=Pb+PbO2+4H+。
①必须预先将阳极金属钛进行“热钝化处理”,原因是_______。
②电解槽中,阳极主要的反应式为___;该法的缺点是阳极、阴极均会发生副反应。其中阴极上产生的气体副产物是____。
③电解法制得的PbO2晶体中含有少量的+2价铅,从而导致氧原子所在位置出现少量“空穴”(即化学式为PbOx,但x<2)。若电解时每生成1molPbOx转移1.94NA个e-(NA为阿伏加德罗常数的值),则铅元素中+2价铅所占的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
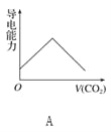
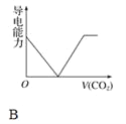

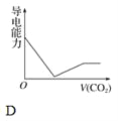
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO
、OH-、Cl-、CO![]() 、Xn-(n=1或2)中的一种。
、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是_____和_____。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.CH3COO- C.SO![]() D.HCO
D.HCO![]()
(3)将38.4 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的________(填相应的离子符号),写出Cu溶解的离子方程式____________________________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是_____________。
(4)E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的离子方程式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com