
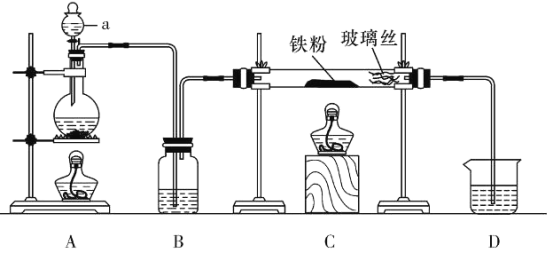
【题目】化学是一门以实验为基础的学科。下列实验装置和方案能达到相应目的是( )
A. 图装置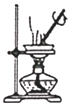 ,加热蒸发碘水提取碘
,加热蒸发碘水提取碘
B. 图装置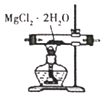 ,加热分解制得无水Mg
,加热分解制得无水Mg
C. 图装置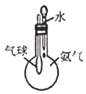 ,验证氨气极易溶于水
,验证氨气极易溶于水
D. 图装置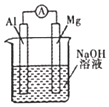 ,比较镁、铝的金属性强弱
,比较镁、铝的金属性强弱
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢化热是指一定条件下,lmol不饱和化合物加氢时放出的热量。表中是环己烯(![]() ),环己二烯(
),环己二烯(![]() )和苯的氢化热数据:
)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ·mol-1) | ﹣119.7 | ﹣232.7 | ﹣208.4 |
根据表中数据推断正确的是( )
A.环己烯、环己二烯和苯分别跟氢气反应,环己二烯跟氢气反应最剧烈
B.环己烯、环己二烯和苯都含有相同的官能团
C.环己烯、环己二烯和苯相比较,苯最稳定
D.上述条件下,lmol![]() 转变为
转变为![]() 时吸收热量
时吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
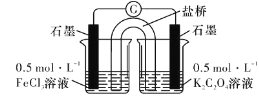
【题目】文献表明:工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论,雅礼中学化学研究性小组进行以下实验:
资料:i. 草酸(H2C2O4)为二元弱酸。
ii. 三水三草酸合铁酸钾[K3Fe(C2O4)33H2O]为翠绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-![]() Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii.FeC2O42H2O为黄色固体,溶于水,可溶于强酸。
(实验1)用以下装置制取无水氯化亚铁
(1)仪器a的名称为___________。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________。
(3)若用D的装置进行尾气处理,存在的问题是__________、___________。
(实验2)通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。

(4)取实验2中少量晶体洗浄,配成溶液,漓加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是______________。
(5)经检验,翠绿色晶体为K3Fe(C2O4)33H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是_____。
(6)取实验2中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:_____Fe(C2O4)3]3-+____H2O![]() ____FeC2O4·2H2O↓+__________+_______
____FeC2O4·2H2O↓+__________+_______
(实验3)研究性小组又设计以下装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
(7)描述达到期目的可能产生的现象:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化。已知B分子组成中z原子个数比C分子中多一个。

请回答下列问题:
(1)元素x的原子结构示意图___;元素y在周期表中的位置是___;
(2)写出单质氟与C反应的离子反应方程式:___。
(3)Y与X在一定条件下生成化合物A的化学方程式:___。
(4)一定条件下,将盛有10mLA的大试管倒置于水槽的水中然后缓缓通入Y至液体刚好充满试管,写出反应的化学方程式___;通入相同状况下气体Y的体积为___。
(5)用电子式表示B的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸。几种物质之间的转化关系如图所示(生成物中所有无机物均已略去)。

请回答下列问题:
(1)写出物质的结构简式:A____________,C___________,E____________。
(2)在①~⑥6个反应中,属于消去反应的是________(填编号,下同),属于酯化反应的是________。
(3)写出下列反应的化学方程式:
①_____________________________________________________;
②____________________________________________________;
⑥_____________________________________________________。
H→I_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
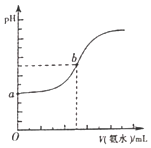
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
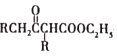 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
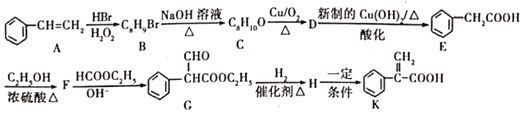
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(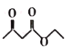 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是__,还原性I-__NO(填“>”或“<”)。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有__(填序号)。
(3)请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+_H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为__L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com