
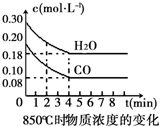
 在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g).CO和H2O(g)浓度变化如图| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)由图可知,CO起始浓度为0.2mol/L、H2O的起始浓度为0.3mol/L,850℃时4min达到平衡,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.18 0.12 0.12
根据v=$\frac{△c}{△t}$计算v(CO);
(2)平衡常数K=$\frac{生成物平衡浓度的幂次方乘积}{反应物平衡浓度的幂次方乘积}$;
(3)CO转化率=$\frac{CO浓度变化量}{CO的起始量}$×100%;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
起始浓度与(1)中相同,而(1)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,降低温度平衡向放热反应进行,反应速率减小,根据影响平衡常数及反应速率的因素判断;
(5)①3min、4min时同种物质的浓度相等,处于平衡状态;
起始浓度与(1)中相同,而(1)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,升高温度平衡逆向移动,故该温度下平衡时CO的浓度比原平衡850℃大;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度.
解答 解:(1)由图可知,CO起始浓度为0.2mol/L、H2O的起始浓度为0.3mol/L,850℃时4min达到平衡,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始浓度(mol/L):0.2 0.3 0 0
变化浓度(mol/L):0.12 0.12 0.12 0.12
平衡浓度(mol/L):0.08 0.18 0.12 0.12
v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),
故答案为:0.03;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)
平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)c({H}_{2}O)}$,
故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)c({H}_{2}O)}$;
(3)依据(1)中的计算得到CO转化率=$\frac{0.12mol/L}{0.2mol/L}$×100%=60%;
故答案为:60%;
(4)CO(g)+H2O(g)?CO2(g)+H2(g).所以是气体体积不变的放热反应,
A.反应前后气体系数和相等,容器中压强始终保持不变,不能说明反应达到了平衡,故A错误;
B.混合气体中c (CO)不变的状态是化学平衡状态的特征,故B正确;
C.速率之比等于化学方程式计量数之比为正反应速率之比,v(H2)正=v(H2O)逆 说明水的正逆反应速率是相等的,反应达到了平衡状态,故C正确;
D.c(CO2)=c(CO)状态不是化学平衡状态的特征,故D错误;
故选BC;
起始浓度与(1)中相同,而(1)中850℃平衡时CO浓度为0.08mol/L,正反应为放热反应,平衡常数只受温度的影响,反应是放热反应,若降低温度,平衡正向进行,该反应的K值将增大,反应的化学反应速率将减小,
故答案为:BC;增大;减小;
(5)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态;该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,即c1>0.08,
故答案为:大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选D;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选A,
故答案为:D;A.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、化学平衡图象等,题目难度中等,注意分析各物质的浓度变化量关系判断改变条件.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| 成分 | 成分的质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
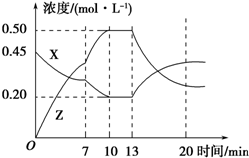
| A. | 用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol•L-1•min-1 | |
| B. | 根据上图可求得化学方程式中a:b=1:3 | |
| C. | 推测在第7 min时曲线变化的原因可能是升温 | |
| D. | 推测在第13 min时曲线变化的原因可能是降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
| Ka或Ksp | Ka=1.8×10-5 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
| A. | 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③ | |
| B. | 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO-)+c(HClO) | |
| C. | AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp | |
| D. | 向浓度均为1×10-3mol•L-1的KCl 和K2CrO4混合液中滴加1×10-3mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Kw均增大 | |
| C. | 25℃时,1.0×10-3mol•L-1盐酸的pH=3.0,1.0×10-8 mol•L-1盐酸的pH=8.0 | |
| D. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com