
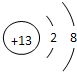
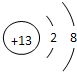


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ⅠA | 0 | |||||||
| ① | ⅡA | … | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ |




查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
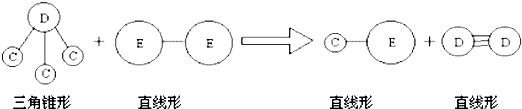
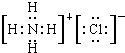
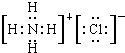
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的_________族
(2)甲元素的气态氢化物的稳定性比HCl的_________(填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是_________,指出它所含的化学键的类型_______________________ 。
(4)乙元素原子半径比丙元素原子_________ (填大或小)
(5)丙元素最高价氧化物的水化物的分子式是_________,它的酸性比磷酸的_________( 填“强”或“弱”)
(6)另有A,B,C三种短周期元素,A和B同周期,A和C同主族,三者的原子序数之和为41,三者的最外层电子总数为19,则推断出的元素依次为A________B________C________. (填元素符号)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省五校协作体高三第二次联合模拟考试理综化学试卷(解析版) 题型:填空题
人民网西昌报道组10月1日电约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。


甲:嫦娥二号发射瞬间 乙:运行中的嫦娥二号
已知A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b = c﹣1;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。
请解答下列问题:
(1)A元素在元素周期表第 族中,D元素在元素周期表第 周期中。
(2)B原子的原子结构示意图: 。
(3)A、B两种元素形成的四原子分子的电子式为 。
(4)上图甲中发生反应的化学方程式为: 。
(5)A、B形成的六原子分子BA2—BA2也可以作为火箭发射中的燃烧剂,此时往往使用A、C形成的四原子分子(A2C2)作为氧化剂。已知8g BA2—BA2与足量A2C2反应,生成物均为无害气体,放出热量为160.35kJ。
请写出上述反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com