
Ⅰ.研究NO
2、SO
2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO
2(g)+O
2(g)?2SO
3(g)△H=-Q
1kJ?mol
-12NO(g)+O
2(g)?2NO
2(g)△H=-Q
2kJ?mol
-1则反应NO
2(g)+SO
2(g)?SO
3(g)+NO(g) 的△H=
kJ?mol
-1.
(2)一定条件下,将NO
2与SO
2以体积比1:2置于密闭容器中发生上述反应,当测得上述反应平衡时NO
2与NO体积比为1:3,则平衡常数K=
1.8
1.8
.
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H
2(g)?CH
3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
<
<
0(填“>”或“<”).
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC
2O
4)溶液显酸性.
(1)用离子方程式解释Na
2C
2O
4溶液显碱性的原因
C2O42-+H2O?HC2O4-+OH-
C2O42-+H2O?HC2O4-+OH-
;
(2)常温下,比较0.1mol?L
-1NaHC
2O
4溶液中各种离子浓度的大小关系
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
;
Ⅲ.某课外活动小组为了探究的BaSO
4溶解度,分别将足量BaSO
4放入:a.5ml 水;b.40ml 0.2mol?L
-1的Ba(OH)
2溶液;c.20ml 0.5mol?L
-1的Na
2SO
4溶液;d.40ml 0.1mol?L
-1的H
2SO
4溶液中,溶解至饱和.
(1)以上各溶液中,的浓度由大到小的顺序为
B
B
;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为
13
13
(设混合溶液的体积为混合前两溶液的体积之和).

 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.

 巧学巧练系列答案
巧学巧练系列答案 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
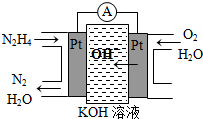 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题