
| 选项 | 实验操作、现象 | 解释、结论 |
| A. | 铜片放入浓硫酸中,无明显变化 | 铜在冷的浓硫酸中会发生钝化 |
| B. | 往某氯化物溶液中滴加氨水,产生白色沉淀 | 该氯化物是AlCl3 |
| C. | 将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 | HA是弱酸 |
| D. | 往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] | 原溶液中 c(Mg2+)=5.6×10-2mol?L-1 |
| A、A | B、B | C、C | D、D |
| 10-14 |
| 10-9 |


科目:高中化学 来源: 题型:
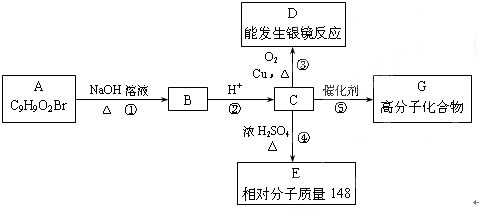
查看答案和解析>>
科目:高中化学 来源: 题型:
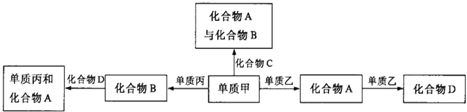
| A、上述转化关系所涉及的化合物中有一种是酸性氧化物 |
| B、甲、乙、丙三种单质的晶体一定是分子晶体 |
| C、上图所示的五个转化关系中,有三个是化合反应 |
| D、上图所示的五个转化关系中,均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c=d |
| B、a>b>d>c |
| C、d>a>c>b |
| D、c>a>b>d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16g | B、32g |
| C、19.2g | D、12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2B溶液存在:c (Na+)=2c (HB-)+2c(B2-)+2c(H2B) |
| B、NaHB溶液一定显酸性 |
| C、HB-的水解方程式:HB-+H2O?H2B+OH- |
| D、NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+=H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③④ |
| C、①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展循环经济,构建资源节约型社会及清洁生产技术 |
| B、采用绿色化学生产工艺,提高原子利用率,建立环境友好型化工体系 |
| C、大量砍伐森林,以满足人们对木材的需求 |
| D、大力开发可再生资源,推广用乙醇汽油代替传统的燃油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com