
【题目】A、B、C、D、E、F、G、H、I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:
(1)B单质分子中![]() 与
与![]() 键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色的络合物;该阴离子又与A—I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为______(写一种即可),该分子中心原子轨道的杂化类型为_______,该阴离子空间构型为_______。
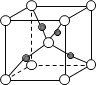
(3)D与G可以形成如图的晶胞,则黑点表示的是元素_______(填写元素符号),该元素原子在该晶胞中的配位数为______。
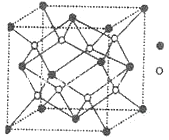
【答案】1:2 O<N<F 3d64s2 CO2(CS2、N2O) sp 直线形 Ca 8
【解析】
在前4周期中:因为A原子的最外层电子是次外层电子数的2倍,故A为C;由D为周期表中电负性最大的元素,D为F;故此,B为N,C为O;H为应用最广泛的金属,故H为Fe;I处于周期表中的第二副族,故I为Zn;又F与C位于同一主族,故F为S;因为E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故E为Mg,G为Ca。
(1)由题干可知B为N,形成的单质是N2,含氮氮三键,故![]() 与
与![]() 键键数目比为1:2;氮原子中2p轨道是半满状态,能量较低,故N、O、F三者第一电离能由小到大的顺序为O<N<F;
键键数目比为1:2;氮原子中2p轨道是半满状态,能量较低,故N、O、F三者第一电离能由小到大的顺序为O<N<F;
(2)由题给条件可知H为Fe,故其价电子排布为:3d64s2;Fe3+遇SCN-生成血红色络合物,SCN-的等电子体有CO2、CS2、N2O等,类比CO2可知其中心原子杂化类型为sp杂化,故空间结构为直线形;
(3)因为D与G分别为F和Ca,分子式为CaF2,由所给晶胞示意图中黑点为4,白点为8,可知黑点为Ca,白点为F;又因为Ca在晶胞中是面心立方,故其配位数为8。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
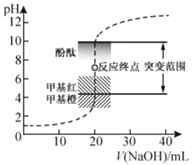
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
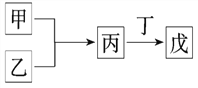
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
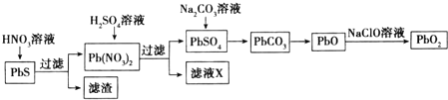
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:
![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
Cu2O+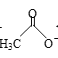
![]()
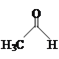
![]()
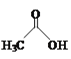
![]()
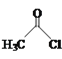
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___。
(3)CH3CHO分子中氧原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
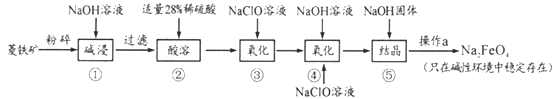
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感冒是一种常见的病,病人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。药物阿司匹林是一种传统的治疗感冒发烧的药,从分子结构上看,它可以看做是乙酸酯,其结构简式为
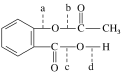
(1)阿司匹林与NaOH溶液反应中,可以断裂的化学键是________(填代号)。
(2)根据阿司匹林的结构推断它能够发生的化学反应类型为________(填序号)。
①中和反应 ②加成反应 ③取代反应
(3)阿司匹林连接在某高分子聚合物上,可形成缓解长效药物,其中的一种结构为
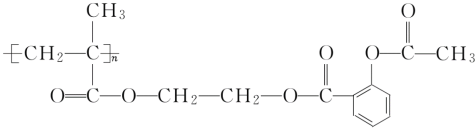
则缓释长效阿司匹林载体的结构简式为_______。
(4)长期大量服用阿司匹林会出现不良反应,一旦出现水杨酸中毒现象,应立即停药,并静脉滴注NaHCO3溶液,以解除水杨酸的中毒症状,反应的化学方程式为_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com