
【题目】
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】下列对合金的说法正确的是( )
A.合金中至少含有两种金属元素,可能不含非金属元素
B.合金中的金属元素以化合物的形式存在
C.一些合金具有固定配比,所以合金是纯净物
D.合金的硬度可以大于成分金属.而熔点可以低于成分金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯可生产多种化工原料,根据如图所示的转化关系回答问题: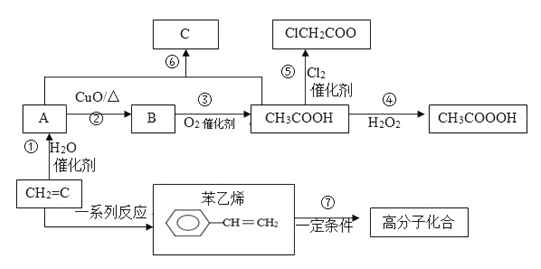
(1)写出下列物质的结构简式:A______;B______;C_______。
(2)反应①~⑦中,属于取代反应的是________(填序号)。
(3)反应②的化学方程式为______________,反应⑦的化学方程式为_________________
(4)苯乙烯是一种重要的化工原料,下列说法正确的___________________
a.该分子中所有原子可能在同一平面上
b.它与足量的H2加成后得到的产物的一溴代物有5种
c.该物质能发生氧化反应和加成反应
(5)重要化工原料氯乙酸(CH2Cl-COOH)与水反应可得到羟基乙酸(HOCH2-COOH),羟基乙酸与反应⑤的产物过氧乙酸互为________(选填“同系物”、“同分异构体”、“同素异形体”或“同位素”);羟基乙酸与乳酸[CH3CH(OH)COOH]的混合物,在浓硫酸作用下脱去一分子水可得到_________种链酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:____________________。
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O ![]() N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O ![]() N2H62+ + OH- II
N2H62+ + OH- II
① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为__________。
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈_________性,溶液中N2H5+、Cl-、OH-、H+、N2H4浓度由大到小的顺序为___________________。

(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g)![]() N2(g)+2H2O(g)
N2(g)+2H2O(g)
温度较高时主要发生反应b:N2H4(g)+2O2(g)![]() 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)
①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1__________K2。(填“>”、“<”或“=”)
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是_______________。
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中![]() 变大的是_______。
变大的是_______。
A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q、W均为短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | W | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 0.077 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | -4,+4 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)Y在元素周期表中的位置是_____。
(2)写出化合物XRM的电子式:_____;比较Z、M、R三种元素对应的简单离子半径大小_____。(用离子符号和“>”表示)
(3)Z与Q相比,金属性较强的是_____(用元素符号表示),下列事实能证明这一结论的是
_____(选填字母序号)。
a.Z的熔点低于Q
b.常温下,Z与水剧烈反应而Q不能
c.最高价氧化物对应的水化物碱性:ZOH > Q(OH)3
d.最外层电子数:Q > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
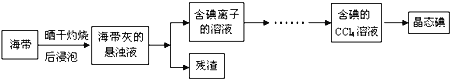
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com