
【题目】将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
A.K+、OH﹣、Cl﹣、SO42﹣
B.H+、NH4+、Al3+、NO3﹣
C.Na+、S2﹣、Cl﹣、SO42﹣
D.Na+、C6H5O﹣、CH3COO﹣、HCO3﹣
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1mol.
(1)烃A的分子式为 .
(2)若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 .
(3)若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A所有可能的结构简式为 , , .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Q与R的摩尔质量之比为9:22,在反应X+2Y===2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为
A. 46∶9 B. 16∶9 C. 7∶3 D. 32∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体这两种分散系的根本区别是( )
A. 是否有丁达尔现象 B. 分散质微粒直径的大小
C. 能否透过滤纸或半透膜 D. 是否均一、稳定、透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
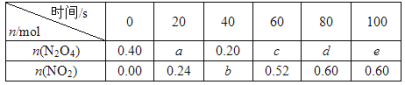
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
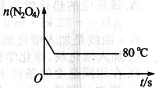
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个反应:
①Fe+H2SO4(稀)===FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
试回答下列问题:
(1)反应①中________(填元素符号)被氧化,还原产物为________;反应②中________作还原剂,________元素被还原。
(2)当反应①生成2 g H2时,消耗H2SO4的质量是________ g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是________ g,其中有________ g H2SO4被还原,转移电子________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com