
分析 (1)根据n=$\frac{m}{M}$、V=nVm计算出标准状况下气体体积;
(2)根据n=$\frac{N}{{N}_{A}}$计算出该气体的物质的量,然后根据M=$\frac{m}{n}$计算出该气体的摩尔质量;
(3)根据n=$\frac{m}{M}$计算出铝离子的物质的量,然后计算出硫酸铝的物质的量,最后根据c=$\frac{n}{V}$计算出硫酸铝的浓度;
(4)根据稀释过程中溶质的物质的量不变计算出稀释后氢氧化钠的浓度.
解答 解:(1)1.7g氨气的物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol,标准状况下0.1mol氨气的体积为:22.4L/mol×0.1mol=2.24L,
故答案为:2.24L;
(2)6.02×1022个分子的物质的量为:$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.1mol,该气体的摩尔质量为:$\frac{6.4g}{0.1mol}$=64g/mol,
故答案为:64g/mol;
(3)ag Al3+的物质的量为:$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,Al2(SO4)3的物质的量为:$\frac{a}{27}$mol×$\frac{1}{2}$=$\frac{a}{54}$mol,则Al2(SO4)3溶液的物质的量浓度为:$\frac{\frac{a}{54}mol}{VL}$=$\frac{a}{54V}$mol/L
,
故答案为:$\frac{a}{54V}$;
(4)将30mL1.0mol/L的NaOH溶液加水稀释到500mL,稀释过程中NaOH的物质的量不变,则稀释后NaOH的物质的量浓度为:$\frac{1.0mol/L×0.03L}{0.5L}$=0.06mol/L,
故答案为:0.06.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
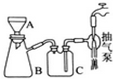 高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程:
高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂.如图是在实验室中制备KMnO4晶体的流程: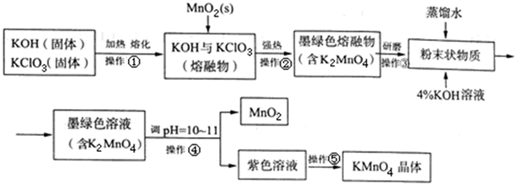
 (3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.
(3)操作④、⑤要用到抽滤装置,仪器B的名称是抽滤瓶,相比普通的过滤,该装置的突出优点是过滤速度快、效果好.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古人利用明矾溶液的酸性来清洗青铜器上的铜锈 | |
| B. | 人体摄入适量的油脂有利于促进维生素的吸收 | |
| C. | 《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,所述过程不涉及化学变化 | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com