
【题目】在某2 L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
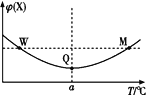
A.M点时,Y的转化率最大B.升高温度,平衡常数减小
C.W点时 v正 = v逆D.W、M两点Y的正反应速率相同
【答案】B
【解析】
温度在a℃之前,升高温度,X的含量减小,温度在a℃之后,升高温度,X的含量增大,曲线上最低点为平衡点,最低点之前未达平衡,反应向正反应进行,最低点之后,各点为平衡点,升高温度X的含量增大,平衡向逆反应方向移动,故正反应为放热反应,据此分析解答。
A.曲线上最低点Q为平衡点,升高温度平衡向逆反应移动,Y的转化率减小,所以Q点时,Y的转化率最大,故A错误;
B.Q点后升高温度平衡逆向移动,正反应为放热反应,则升高温度,平衡常数减小,故B正确;
C.W点不是平衡点,此时反应以正向进行为主,即v正 > v逆,故C错误;
D.W点对应的温度低于M点对应的温度,温度越高反应速率越大,所以W点Y的正反应速率小于M点Y的正反应速率,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式:K=___;
2CO(g)平衡常数K的表达式:K=___;
(2)已知某温度下,反应2SO2(g)+O2(g)![]() 2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
2SO3(g),的平衡常数K=19。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应___(填“是”或“否”)达到化学平衡状态,若未达到,向___(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g)![]() cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
cC(g)+dD(g) △H = m kJ·mol-1;若a+b>c+d,增大压强平衡向___(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则m___0(填“>”或“<”)
(4)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
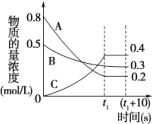
①该反应的化学方程式为:___;
②t1s时反应物A的转化率为:___;
③0~t1s内A的反应速率为v(A)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HClO的Ka=4.7×10-8,在c(H2SO3)+c(HSO![]() )+c(SO
)+c(SO![]() )=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
)=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
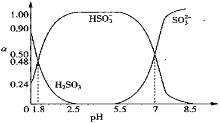
A.pH=7.2时,混合溶液中由水电离的c(H+)=10-7.2
B.等浓度的Na2SO3溶液pH比NaClO溶液的大
C.将等浓度、等体积的NaClO和Na2SO3溶液混合,混合液接近中性
D.Na2SO3溶液中:c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下,1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是( )
A.pHa+pHb=12B.pHa+pHb=13C.pHa+pHb=14D.pHa+pHb=15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
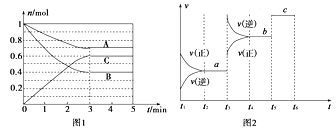
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
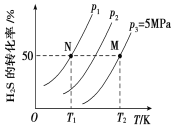
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:
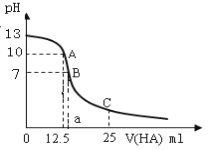
(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
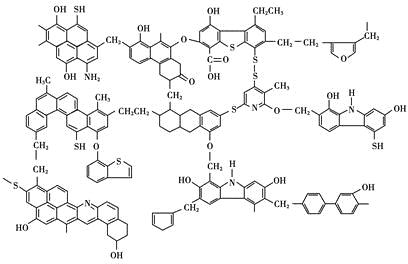
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com