
下列各表述与示意图一致的是

A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
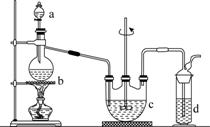
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3 N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2 -2△H1 D.△H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则生成1m3(标准状况)CO所需热量为 :
(3)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体
系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min
的COCl2浓度变化曲线未示出):


①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c (COCl2)= mol·L-1;
(COCl2)= mol·L-1;
④比教产物CO在2−3 min、5−6 min和12−13 min时平均反应速率[平均反应速率分别以v(2−3)、v(5−6)、v(12−13)表示]的大小 ;
⑤比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小: v(5−6) v(15−16)(填“<”、“>”或“=”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应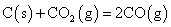 不能自发进行,则该反应的
不能自发进行,则该反应的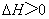
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中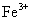 、
、 、
、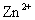 的氧化性依次减弱
的氧化性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )

A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫
酸铁溶液,这种试剂是( )
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是
①非金属置换金属的反应 ②弱酸反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④有单质参加的非氧化还原反应
A.①②③④ B.②④ C.①②③ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com