
下列说法正确的是
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下列说法正确的是
A.冰熔化时,分子中H—O键发生断裂
B.NaOH中只含有离子键
C.CO2与SiO2都属于分子晶体
D.熔沸点由高到低的顺序是金刚石>NaCl>I2
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
(15分)为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=________mol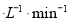 (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol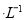 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。)

依据记录数据判断,下列结论中正确的是
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液
B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14
C.将水加热,Kw增大,pH不变
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(15分)请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是_________硝酸(填“浓”或“稀”),相应的离子方程式是_____________.
(2) 800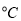 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)  2NO2(g),经5min达到平衡,测得c(NO)=0.5 mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)=0.5 mol/L,并放热QkJ。5min内 v(O2)=___________。
②该条件下,2NO(g)+O2(g)  2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO2各1mol,此时v正 v逆(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入lmolNO2,平衡向_______(填“正向”、“逆向”或“不”)移
动。达新平衡时,NO2的体积分数________(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO2-,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式________
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
对于可逆反应2A(g) +3B(g)  3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A.各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B.平衡混合物体积是反应开始前的3/5
C.平衡混合物中各物质的量浓度相等
D.单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
(2)工业上氨气可以由氢气和氮气合成。
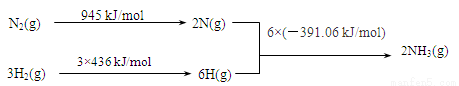
①该反应的热化学方程式是 。
②简述一种检查氨气是否泄露可采用的化学方法: 。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
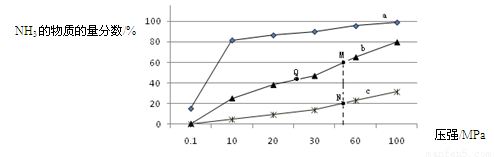
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com