
��������ѧ��ѧ�г��������壬����;�㷺��
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
��2����ҵ�ϰ��������������͵����ϳɡ�
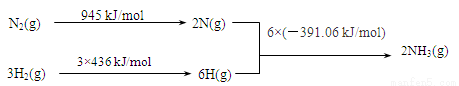
�ٸ÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�ڼ���һ�ּ�鰱���Ƿ�й¶�ɲ��õĻ�ѧ������ ��
��3���±��ǵ���Ӧ���а�n(N2):n(H2)=1:3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߡ�
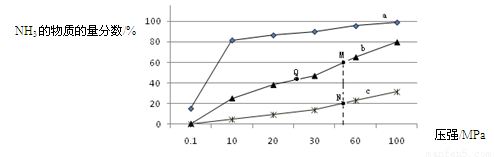
������a��Ӧ���¶��� ��
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ���� (����ĸ)��
A. ��ʱ�����NH3�������H2��ƽ��ת����
B. �Ӵ����ܼӿ췴Ӧ���������H2��ƽ��ת����
C. ��ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ��K(M)= K(Q) >K(N)
�� M���Ӧ��H2ת������ ��
��4����ҵ�������β���к��϶��SO2��Ϊ��ֹ��Ⱦ��������������SO2����ҵ�ϳ���
��ˮ���շ�����β����
�� ����ˮ�������������ʵ���Ϊ3 mol �����ձ�״����44.8 L SO2ʱ����Һ�е���
��Ϊ ��
�� (NH4)2SO3�Լ��ԣ��û�ѧƽ��ԭ������ ��
�� NH4HSO3�����ԡ��ð�ˮ����SO2��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ
���� (����ĸ)��
a��c(NH4��) = 2c(SO32��) �� c(HSO3��)
b��c(NH4��)> c(SO32-)> c(H+)= c(OH-)
c��c(NH4��)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
��5��������һ�ָ���ȼ�ϣ�����ֱ������ȼ�ϵ�أ���ͼ�ǹ���ˮʽȼ�ϵ�ع���ԭ����

�ٰ���ȼ�ϵ�صĵ������Һ���ѡ�� (����ԡ��������ԡ������ԡ�)��Һ��
�ڿ����ڽ�����װ��ǰ��Ҫͨ����������ȥ�������� ��
�۰���ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ������������ˮ���õ�صĵ缫�ܷ�Ӧ�� �������ĵ缫��Ӧ���� ��
��1��2NH4Cl +Ca(OH)2��2NH3��+CaCl2 +2H2O (1��)
��2����N2(g) +3H2(g)  2NH3(g)
2NH3(g) 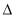 H= ��93.36 kJ/mol (1��)
H= ��93.36 kJ/mol (1��)
�ڽ�ʪ��ĺ�ɫʯ����ֽ�ӽ��������۲���ֽ�Ƿ�������������˵���а���й¶��(��պȡŨ����ӽ��������۲��Ƿ��а������ɣ�����а�������˵���ܵ�й¶��) (1��)
��3���� 200��(1��) �� AC(1��) �� 75%(1��)
��4���� (NH4)2SO3��NH4HSO3(1��)
�� NH4+ + H2O NH3��H2O + H+ SO32��+H2O
NH3��H2O + H+ SO32��+H2O HSO3��+ OH��, SO32��ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c(OH-) > c(H+)����Һ�ʼ��ԡ�(1��)
HSO3��+ OH��, SO32��ˮ��̶ȴ���NH4+ ��ˮ��̶�ʹ��Һ��c(OH-) > c(H+)����Һ�ʼ��ԡ�(1��)
�� a b(2��)
��5���ټ���(1�� ��CO2(1��) �� 4NH3+ 3O2 = 2N2 + 6H2O (1��)
3O2 + 12e��+ 6H2O = 12OH��(1��)�� O2 + 4e��+ 2H2O = 4OH��
��������
�����������1��ʵ������ȡ�����Ļ�ѧ����ʽ��2NH4Cl +Ca(OH)2��2NH3��+CaCl2 +2H2O��
��2���ٸ÷�Ӧ�ġ�H=945 kJ/mol+3��(436 kJ/mol)-6��(��391.06 kJ/mol)= ��93.36 kJ/mol��
�ڼ�鰱���Ƿ�й¶�У���ʪ��ĺ�ɫʯ����ֽ�ӽ��������۲���ֽ�Ƿ�������������˵���а���й¶��(��պȡŨ����ӽ��������۲��Ƿ��а������ɣ�����а�������˵���ܵ�й¶��
��3��������a��NH3�����ʵ�����������ϳɰ�Ϊ���ȷ�Ӧ���ʶ�Ӧ���¶���ͣ���200�档
���㣺������Ϊ�����ķ��㻯��������ʡ�
��A.��ʱ�����NH3����ʹƽ�������ƶ����������H2��ƽ��ת���ʣ�
B. �Ӵ����ܼӿ췴Ӧ���ʣ��������ƻ��ƻ����������H2��ƽ��ת���ʣ�
C.�ϳɰ�Ϊ�����С�ķ�Ӧ��ѹǿԽ��ƽ�ⳣ��KԽ��K(M)= K(Q) >K(N)��
��N2(g) +3H2(g)  2NH3(g)
2NH3(g)
1 3 0
�仯:1x 3x 2x
M���Ӧ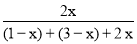 =60%��H2ת����75%��
=60%��H2ת����75%��
��4���� ����ˮ�������������ʵ���Ϊ3 mol �����ձ�״����44.8 L��2molSO2ʱ����Һ�е���
�ʺ�NH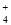 ��S�ĸ�����Ϊ3:2������1:1��(NH4)2SO3��NH4HSO3��
��S�ĸ�����Ϊ3:2������1:1��(NH4)2SO3��NH4HSO3��
�� (NH4)2SO3�Լ��ԣ���SO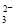 ˮ���Ե�ʡ�
ˮ���Ե�ʡ�
�� NH4HSO3�����ԡ��ð�ˮ����SO2��������Һ������ʱ��
a����Ϊc(NH4��)+ c(H��)= 2c(SO32��) �� c(HSO3��)+ c(OH��)�����Եó�c(NH4��) = 2c(SO32��)�� c(HSO3��)��
b��NH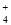 Ϊ��ֱ�ӵ�������ӣ�SO
Ϊ��ֱ�ӵ�������ӣ�SO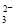 ��HSO
��HSO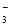 ��������ӣ���c(NH4��)> c(SO32-)��
��������ӣ���c(NH4��)> c(SO32-)��
c���ɵ���غ㣺c(NH4��)+ c(H+)=2 c(SO32-)+c(HSO3-)+c(OH-)
��5���۰���ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ�������������N2��ˮ����4NH3+ 3O2 = 2N2 + 6H2O�������ĵ缫��Ӧ����O2 + 4e��+ 2H2O = 4OH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����и߶���ѧ���������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��ǿ����ʵ�ˮ��Һ�в��������ʷ��ӣ�������ʵ�ˮ��Һ�д������ʷ��Ӻ�����
B��ǿ����ʵ�ˮ��Һ������ǿ��������ʵ�ˮ��Һ
C��ǿ����ʶ������ӻ����������ʶ��ǹ��ۻ�����
D��ǿ�����������ˮ���������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����и�һ��ѧ���������Ի�ѧ��A�����Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A���ڹ��ۻ�������һ�����й��ۼ�
B���������Ӽ��Ļ�����һ�������ӻ�����
C�����й��ۼ��Ļ�����һ���ǹ��ۻ�����
D����ѧ��Ӧ�����У���Ӧ������ڵĻ�ѧ�����ѣ�������ӵĻ�ѧ���γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и����꼶�����ο������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ݱ�����Ϣ���ж�������������ȷ����
A�����Т���ķ�Ӧֻ������һ��Ԫ�ر�������һ��Ԫ�ر���ԭ
B��������ǿ���ıȽϣ� KClO3��Fe3+��Cl2��Br2
C���ɱ��Т٢��鷴Ӧ�Ʋ⣺ClO3����Br����H+��Fe2+������Ũ��Һ�д�������
D�����Т��鷴Ӧ�����ӷ���ʽΪ��2MnO4��+ 3H2O2 + 6H+=2Mn2+ + 4O2��+ 6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и����꼶�����ο������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A�� ������Դ������Ҫ;������������
B�� ���ճ������У���ѧ��ʴ����ɸ�����ʴ����Ҫԭ��
C�� �ƹ�ʹ������Դ�����Լ��ٶ�����̼������������ŷ�
D�� ������ά���ϳ���ά���ά�����л��߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и�����ѧ��ͳ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л�����������ȷ����( )
A�����顢�ױ����Ҵ������ᶼ���Է���ȡ����Ӧ
B��ú�к��б����ױ������ױ��ȷ���������ͨ��������ȡ
C�����ǿ���ˮ�����������Ǻ���
D��ֲ����ͨ��������Ա�Ϊ֬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��������ѧ�����п��Ը߶���ѧ�Ծ��������棩 ���ͣ������
��10�֣����������Ǽ��ֳ����㾫����Ҫ�ɷ�
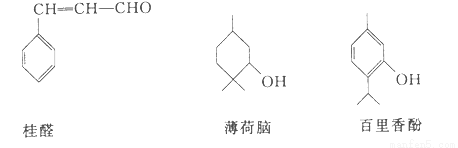
��1�������Եķ���ʽΪ___________��
��2�����𱡺��ԺͰ�����ӣ���ѡ�õ��Լ���___________ ��
��3�����ж��ڹ�ȩ��˵������ȷ����___________ ��
A���ɷ����Ӿ۷�Ӧ B���ɷ���ȡ����Ӧ
C���ɷ���������Ӧ D��������2 molH2�����ӳɷ�Ӧ
��4��д���������������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽ��
__________________________________________________________________��
��5��д���������������Һ��ͨ��CO2����Ļ�ѧ��Ӧ����ʽ��
__________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��������ѧ�����п��Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������Ѻ��Ҵ��ɲ��û�ѧ�������������������з������ܶԶ��߽��м������
A�����ý����ƻ�����ط� B�����ú������
C���������� D�����ú˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и���������ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��12�֣���������ƣ�Na2S2O3��5H2O�����������մ��ֳ�Ϊ������������������ˮ���������Ҵ��������ֽ⡣��ҵ�ϳ����������Ʒ�������Ʊ���ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ�����ͼ��ʵ������������Ϊ��

�ٿ�����Һ©����ʹ�����������£��ʵ����������У�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ������Ž�����������
����������������ʧ��������Һ��pH�ӽ�
7ʱ��ֹͣͨ��SO2���塣
�۳������õ���Һ��ת�����������У�ˮԡ����
Ũ����ֱ����Һ������־�Ĥ��
����ȴ�ᾧ�����ˡ�ϴ�ӡ�
�ݽ������������У���40��45�����Ҹ���
50��60min��������
��ش��������⣺
��l������a�������� ��
��2���������������pHֵС��7������ʻ��½����������ӷ���ʽ����ԭ�� ��
��3��������в��ܽ���Һ�������ɵ�ԭ���� ����Ĥͨ������Һ������ֵ�ԭ���� ��
��4���������ϴ����������ƾ��������Լ��Ľṹʽ�� ��
��5��Ϊ�����ƵõIJ�Ʒ�Ĵ��ȣ���ʵ��С���ȡ5,0�˵IJ�Ʒ���Ƴ�250mL�����������Һ�����ü�ӵ������궨����Һ��Ũ�ȣ�����ƿ�м���25mL 0��0lmol��L-1 KIO3��Һ�������������KI���ữ���������з�Ӧ��5I��+IO3��+6H+=3I2+3H2O���ټ��뼸�ε�����Һ������������Na2S2O3��Һ�ζ���������Ӧ��I2+2S2O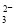 =2I��+S4O
=2I��+S4O ������ɫ��ȥH����Ӳ���ɫʱ����ζ��յ㡣ʵ���������±���
������ɫ��ȥH����Ӳ���ɫʱ����ζ��յ㡣ʵ���������±���
ʵ����� | 1 | 2 | 3 |
Na2S2O3��Һ�����mL�� | 19.98 | 20.02 | 21.18 |
��ò�Ʒ�Ĵ�����____ ����ӵ������ζ������п������ʵ����ƫ�͵���____ ��
A���ζ���ĩ��Na2S2O3��Һ��ϴ B���ζ��յ�ʱ���Ӷ���
C����ƿ������ˮ��ϴ D���ζ��ܼ��촦�ζ�ǰ�����ݣ��ζ��յ㷢������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com