
【题目】t℃时,100mLNaNO3饱和溶液的质量为137g,如将这些溶液蒸干,获得62.5g NaNO3固体。下列说法中,不正确的是
A. t℃时,NaNO3饱和溶液密度为1.37g/cm3
B. t℃时,NaNO3的溶解度约为83.9g
C. t℃时,NaNO3饱和溶液中溶质的质量分数约为45.6%
D. t℃时,NaNO3饱和溶液中溶质的物质的量浓度约为1.61mol/L
【答案】D
【解析】
A.溶液的体积是100mL,溶液的质量是137g,所以根据密度定义式可得溶液的密度为![]() g/mL=1.37g/cm3,A正确;
g/mL=1.37g/cm3,A正确;
B.饱和溶液的质量为137g,溶质质量是62.5g,溶剂质量是m(溶剂)=137g-62.5g=74.5g,根据溶解度的概念可知,在100g溶剂中形成饱和溶液时溶解的溶质质量为S,则100:74.5=S:62.5,解得S=83.9g,B正确;
C.饱和溶液的质量为137g,溶质质量是62.5g,则该饱和溶液中溶质的质量分数为![]() 45.6%,C正确;
45.6%,C正确;
D.溶质质量是62.5g,则溶质的物质的量是n(NaNO3)=![]() ,由于溶液的体积为100mL,所以溶液的物质的量浓度为c=
,由于溶液的体积为100mL,所以溶液的物质的量浓度为c=![]() ,D错误;
,D错误;
故合理选项是D。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】工业上常用硫铁矿(FeS2)焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
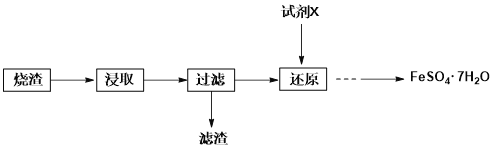
(1)试剂X可能为______________。
A.双氧水 B.酸性高锰酸钾 C.浓硫酸 D.SO2
(2)从还原后溶液中得到产品,应进行的操作是___________、____________、过滤、洗涤、干燥。
(3)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成500 mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,逐渐滴加0.0500 mol/L的酸性KMnO4溶液,至恰好完全反应,记录消耗的酸性KMnO4溶液的体积(假定药品中其他成分不与酸性KMnO4反应);
步骤c:重复步骤b2~3次,平均消耗酸性KMnO4溶液20.00mL。
已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则该补血剂中亚铁离子的含量为_____mg/片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是

A. 起始滤液常温下pH﹥7 B. 试剂Ⅰ为BaCl2溶液
C. 上图过程必须经2次过滤 D. 步骤③目的是除去CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年11月30日第21届联合国气候大会在巴黎召开,会议的一项主题是温室气体减排。如图是科学家正在研发的实现CO2和H2合成甲醇的燃烧电池。下列叙述正确的是
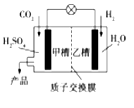
A.乙槽中反应生成水
B.甲槽中的电极反应式为:CO2+6e-+5H2O=CH3OH+6OH-
C.质子从乙槽通过质子交换膜进入甲槽
D.放电过程中,乙槽的电极附近溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)Al2(SO4)3+3H2 ![]() Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
(2)6KMnO4 +5KI +3H2O= 6KOH+6MnO+5KIO3 电子转移_____________ 氧化剂是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. CaO+H2O=Ca(OH)2 B. 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C. SO2+H2O2=H2SO4 D. Cu(OH)2![]() CuO+H2O
CuO+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com