
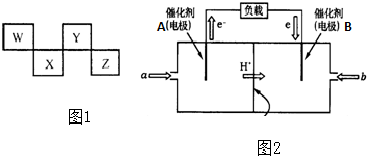
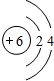 ,能说明Cl的非金属性比P的金属性强的事实是有:HClO4的酸性强于H3PO4等,
,能说明Cl的非金属性比P的金属性强的事实是有:HClO4的酸性强于H3PO4等, ;HClO4的酸性强于H3PO4;
;HClO4的酸性强于H3PO4;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.氨分子的空间构型为
I.氨分子的空间构型为查看答案和解析>>
科目:高中化学 来源: 题型:
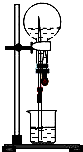 以下是针对喷泉实验所得溶液浓度问题的探讨,请根据题意回答问题.
以下是针对喷泉实验所得溶液浓度问题的探讨,请根据题意回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com