
| A. | 等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | |
| D. | 在强酸强碱稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ |
分析 A、硫蒸气变化为硫固体为放热过程;
B、.需要加热才能进行的化学反应不一定是吸热反应;
C、氢气燃烧反应是放热反应;
D、浓硫酸溶于水放热.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B、需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,故B错误;
C、在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8KJ/mol,故C错误;
D、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸溶于水放热,将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ,故D正确;
故选D.
点评 本题考查了反应热量变化,热化学方程式的正误判断,物质能量与稳定性的比较方法,题目难度中等.


科目:高中化学 来源: 题型:多选题
| 化学式 | pKsp | pH | |
| 开始沉淀时 | 沉淀完全时 | ||
| Mg(OH)2 | / | 10.8 | 13.3 |
| Cu(OH)2 | / | 4.4 | / |
| Fe(OH)3 | / | 1.5 | / |
| Al(OH)3 | 33 | / | / |
| A. | Mg(OH)2不溶于pH=7的CH3COONH4溶液 | B. | PKsp[Mg(OH)2]>PKsp[Cu(OH)2] | ||
| C. | Fe(OH)3的PKsp=38.5 | D. | Al3+在溶液中沉淀完全的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
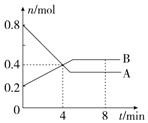 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
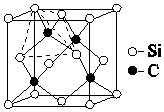 C和Si元素在化学中占有极其重要的地位:
C和Si元素在化学中占有极其重要的地位:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
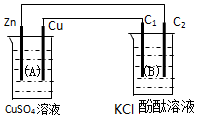 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com