
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,试回答:
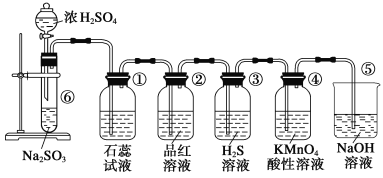
(1)在⑥中发生反应的化学方程式为___________。
(2)②中的品红溶液__________,证明SO2有________性。
(3)④中的实验现象是______,证明SO2有______性。
(4)⑤的作用是________,反应的化学方程式为________。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 红色褪去 漂白性 紫红色褪去 还原性 尾气处理,吸收多余的SO2 ,防止污染空气 2NaOH+SO2=Na2SO3+H2O
【解析】
在试管⑥中亚硫酸钠与浓硫酸反应生成SO2、Na2SO4和水,反应产生的SO2与水作用产生H2SO3,具有酸性,可以使紫色石蕊试液变为红色;SO2具有漂白性,与品红溶液作用生成无色物质,而能使品红溶液褪色;SO2具有氧化性,与H2S在溶液中发生氧化还原反应,产生S单质,使溶液变浑浊,SO2具有还原性,能够被KMnO4氧化而使溶液紫色褪去;SO2是有毒气体,不能直接排放到空气中,可以利用其与碱反应的性质,用氢氧化钠溶液进行尾气处理。
(1)⑥中为亚硫酸钠和浓硫酸反应生成、Na2SO4、SO2、H2O,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2) SO2具有漂白性,与②中的品红作用生成无色物质,能使品红溶液褪色;
(3)SO2具有还原性,能够与④中的KMnO4发生氧化还原反应生成硫酸钾、硫酸锰和硫酸,使KMnO4溶液的紫红色的褪色,SO2表现还原性,KMnO4表现氧化性;
(4)SO2具有有毒,不能直接排放到空气中,由于SO2是酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3+H2O。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
![]() 写出符合下列条件的A的同分异构体的结构简式: ______ 。
写出符合下列条件的A的同分异构体的结构简式: ______ 。
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
![]() 化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______
化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是______ ![]() 填字母
填字母![]() 。
。
A.能与氯化铁溶液显色![]() 分子中含有羧基、羟基等官能团
分子中含有羧基、羟基等官能团
C.能与溴水反应![]() 能与碳酸钠溶液反应产生二氧化碳
能与碳酸钠溶液反应产生二氧化碳
![]() 化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为 ______ 。
![]() 化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去。
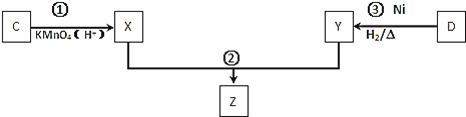
反应![]() 中D与
中D与![]() 按物质的量1:1反应生成Y,则反应
按物质的量1:1反应生成Y,则反应![]() 的化学方程式为 ______ 。
的化学方程式为 ______ 。
![]() 化合物D与银氨溶液反应的化学方程式
化合物D与银氨溶液反应的化学方程式![]() 有机物用结构简式表示
有机物用结构简式表示![]() : ______ 。
: ______ 。
![]() 化合物F是合成克矽平的原料之一,
化合物F是合成克矽平的原料之一,![]() 克矽平是一种治疗矽肺病的药物
克矽平是一种治疗矽肺病的药物![]() ,其合成路线如下
,其合成路线如下![]() 反应均在一定条件下进行
反应均在一定条件下进行![]() :
:

![]() 反应
反应![]() 是原子利用率
是原子利用率![]() 的反应,则该反应的化学方程式为 ______ ;
的反应,则该反应的化学方程式为 ______ ;
![]() 上述转化关系中没有涉及的反应类型是 ______
上述转化关系中没有涉及的反应类型是 ______ ![]() 填代号
填代号![]() 。
。
![]() 加成反应
加成反应![]() 消去反应
消去反应![]() 还原反应
还原反应![]() 氧化反应
氧化反应![]() 加聚反应
加聚反应![]() 取代反应。
取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
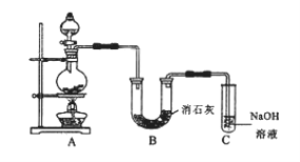
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式____;
(2)C装置的作用是____。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理。

根据要求回答相关问题:
(1)甲装置中,通入氢气的电极为________(填“正极”或“负极”),该极电极反应式为________;若将KOH溶液换成硫酸溶液,则正极电极反应式为__________________________。
(2)关于乙装置,下列说法正确的是________(填序号);
①溶液中Na+向C极移动
②从C极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下Fe极产生2.24L气体,则溶液中转移0.2mol电子
该装置中发生的总反应的离子方程式为__________________________。
(3)乙装置中,X为阳离子交换膜,反应一段时间后交换膜左侧溶液中pH____(填“增大”、“减小”或“不变”);若用饱和MgCl2溶液代替饱和氯化钠溶液,则该装置中发生的总反应______(填“改变”或“不变”)。
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”),精铜电极上的电极反应式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式________________.
(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).
(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是
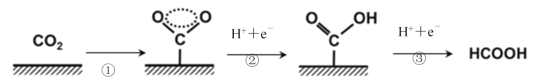
A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O-H键和C-H键
C.CO2和HCOOH中均只含有极性共价键
D.每1molCO2完全转化为甲酸需得2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Q、X、Y、Z的原子序数逐渐增大,Q的单质是空气的主要成分之一,X与Q同周期,且X是该周期中非金属性最强的元素,Y、Z原子的最外层电子数之和为10,Y与Z形成的某种阴离子的结构如图所示.下列说法正确的是
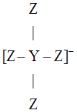
A.X、Z的简单氢化物的水溶液均为强酸
B.Y的单质在常温下性质稳定,不与强酸、强碱反应
C.Y与Z形成的化合物可用作高温结构陶瓷材料
D.简单氢化物的稳定性:Q<X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com